TAXONOMÍA Y NOMENCLATURA
FAMILIA Psittacidae
GÉNERO Rhynchopsitta
ESPECIE pachyrhyncha
NOMBRE CIENTÍFICO Rhynchopsitta pachyrhyncha
NOMBRE COMÚN Cotorra serrana occidental, loro piquigordo, periquito de pico grueso
ESTATUS NOM-059-SEMARNAT-2010 En Peligro de Extinción
ESTATUS LISTA ROJA UICN: En Peligro
BIOLOGÍA
Descripción de la especie: El plumaje del adulto por lo general es verde brillante, en los pómulos y plumas que cubren el oído es un poco más claro y amarillento, la frente y la amplia franja supraciliar son rojas y tienen una marca café al frente y arriba de los ojos (Figura 1). El pico es muy fuerte y de color negro. La zona de flexión de las alas, el borde carpal y los muslos son rojos, las alas cobertoras inferiores de mayor tamaño son amarillentas, los flancos de vuelo y las plumas de la cola son grisáceos, el iris amarillo-naranja y las patas son grises (Forshaw 1989). En vuelo se puede distinguir una amplia coloración amarilla bajo las alas. No presentan dimorfismo sexual.
 Figura 1. Ejemplar de R. pachyrhyncha en el Área de Protección de Flora y Fauna Tutuaca.
Figura 1. Ejemplar de R. pachyrhyncha en el Área de Protección de Flora y Fauna Tutuaca.
Medidas morfométricas: R. pachyrhyncha tiene un tamaño mediano, mide en promedio de 38 cm de largo (Smith 1973) con un peso en promedio de 425 g.
Reproducción: Este psitácido se reproduce en los bosques de coníferas del noroeste de México, la temporada reproductiva concuerda con la maduración de las semillas de los pinos que son su principal fuente de alimento (Lanning y Shiflett 1983). Las parejas reproductoras de las cotorras descansan en las cavidades de anidación durante la temporada reproductiva (CONANP 2010).
Desarrollo: Las cotorras ponen de dos a cuatro huevos entre mediados de junio y finales de julio. El periodo de incubación es de 24 a 27 días (Snyder et al 1999). De uno a tres polluelos salen de su nido entre principios de septiembre y finales de octubre.
Alimentación: La cotorra serrana occidental presenta una conducta nomádica invernal en busca de su especializada dieta que consiste en semillas de pino (Monterrubio y Enkerlin-Hoeflich 2004), aunque también suele alimentarse de frutos silvestres, piñones, bellotas y retoños de algunas plantas.
ECOLOGÍA
Distribución: Su distribución histórica abarcaba porciones de las montañas del sureste de Arizona y suroeste de Nuevo México, actualmente solo habita en los bosques de confieras de la Sierra Madre Occidental, desde Michoacán, Jalisco y Nayarit al sur durante el invierno, hasta Chihuahua al norte donde anida (Monterrubio y Enkerlin-Hoeflich 2004). En México su rango de distribución se extendía desde el norte de Chihuahua y Sonora hasta Michoacán y Jalisco (Forshaw 1989, Howell y Webb 1995) y los sitios ocupados más sureños comprendian Veracruz y Edo. de México (CONANP-Pronatura Sur 2008).
Hábitat: A diferencia de la mayoría de los psitácidos que habitan en ambientes tropicales a baja elevación, R. pachyrhyncha habita en bosques templados de confieras y anida en cavidades de grandes árboles en decaimiento o muertos, a elevaciones superiores a los 2, 000 msnm (Monterrubio y Enkerlin-Hoeflich 2004). Utiliza bosques con distintos relieves geográficos desde mesetas altas con bosques abiertos de pinos, hasta laderas pronunciadas con bosques puros y densos de Abies y Pseudostuga (Lanning y Shifflet 1983).
Comportamiento: No presenta un comportamiento tan territorial en torno al nido como otros psitácidos, son sociables en todas las épocas del año. Sus fuertes vocalizaciones, vistosos colores y la tendencia a formar grandes bandadas la hacen ser una especie sumamente conspicua (Figura 2). Las cavidades que utilizan tienen las entradas picoteadas, con lo cual evidencian su uso. Los restos de alimentos de piñas en el suelo y colgantes delatan su presencia en el sitio.
 Figura 2. Bandada de cotorras serranas occidentales.
Figura 2. Bandada de cotorras serranas occidentales.
Amenazas: Sus poblaciones han experimentado un declive dramático en las últimas décadas (Snyder et al 1999, Lanning y Shifflet 1983). La explotación forestal intensiva a gran escala de pinos y confieras de gran tamaño y la remoción del arbolado muerto en pie, han afectado la disponibilidad de alimento y de sitios de anidación; considerándose estos factores como influyentes en el declive de la especie y además como determinantes en la extinción de otra especie con la que compartía el hábitat y que presentaba requerimientos similares como el carpintero imperial Campephilus imperialis (Snyder et al 1999). Por otra parte la fidelidad a los sitios de anidación, el requerimiento de fuentes de agua y patrones de horarios predecibles para beber agua y alimentar a los pollos incrementa su grado de vulnerabilidad.
MONITOREO
Los bosques de antiguo crecimiento son un hábitat irremplazable que proporciona servicios ecológicos de enorme valor (Figura 3). Algunas de sus etapas de sucesión llegan a los 400 años y son vitales para muchas especies. Estos bosques han desaparecido casi por completo, menos del 0.06 % de la cubierta forestal original de la ecoregión de la Sierra Madre Occidental aún sobrevive (BirdLife International 2008, Lammertink et al 1996). Una de las especies más conspicuas y vulnerables de este ecosistema es R. pachyrhyncha, depende estrechamente de estos bosques, especialmente de árboles viejos o deteriorados que le proporcionan refugio.
 Figura 3. Bosque maduro de coníferas, hábitat característico de R. pachyrhyncha en la Sierra Madre Occidental.
Figura 3. Bosque maduro de coníferas, hábitat característico de R. pachyrhyncha en la Sierra Madre Occidental.
Este hábitat ha sido impactado por la industria maderera, pastoreo, incendios forestales y la degradación en general. Lo anterior, la convierte en una excelente especie indicadora de disturbios y/o afectaciones en el ecosistema. Ante esto, la identificación de los sitios adecuados para su anidación es una prioridad. El presente estudio es una continuación del esfuerzo de investigación y conservación realizado en los últimos años y que ha brindado importantes conocimientos y beneficios para la especie. El objetivo general es conocer la distribución y tendencias poblacionales actuales de R. pachyrhyncha en las Áreas de Protección de Flora y Fauna Tutuaca, Papigochic y Campo Verde, en la Reserva de la Biosfera de Janos y en la Región Prioritaria para la Conservación Madera; esto mediante el monitoreo en su distribución geográfica de anidación, lo que permitirá orientar los esfuerzos de conservación, además de caracterizar el hábitat de anidación e identificar los factores que están relacionados con la anidación de la cotorra serrana occidental.
Metodología: El área de estudio comprende la región denominada el Archipiélago Madréense, esta incluye un amplio conjunto de pequeñas serranías que han surgido de manera dispersa como resultado de procesos geológicos, se ubican a lo largo de un extenso corredor comprendido entre las montañas Rocallosas en Estados Unidos y la Sierra Madre Occidental en México. Es un espacio de transición ecológica único en el mundo, en el que dos inmensas regiones, el ártico y el trópico, comparten sus fronteras biológicas. El APFF Tutuaca se ubica en la región sur del municipio de Temosáchic en el estado de Chihuahua, su superficie calculada es de 444, 488.69 ha abarcando el ejido Tutuaca, Conoachi, La Posta, Comunidad Tutuaca, Comunidad Tosanachi y la propiedad privada Los Chiqueritos. Colinda en su parte suroeste con el APFF Papigochic (Figura 4).
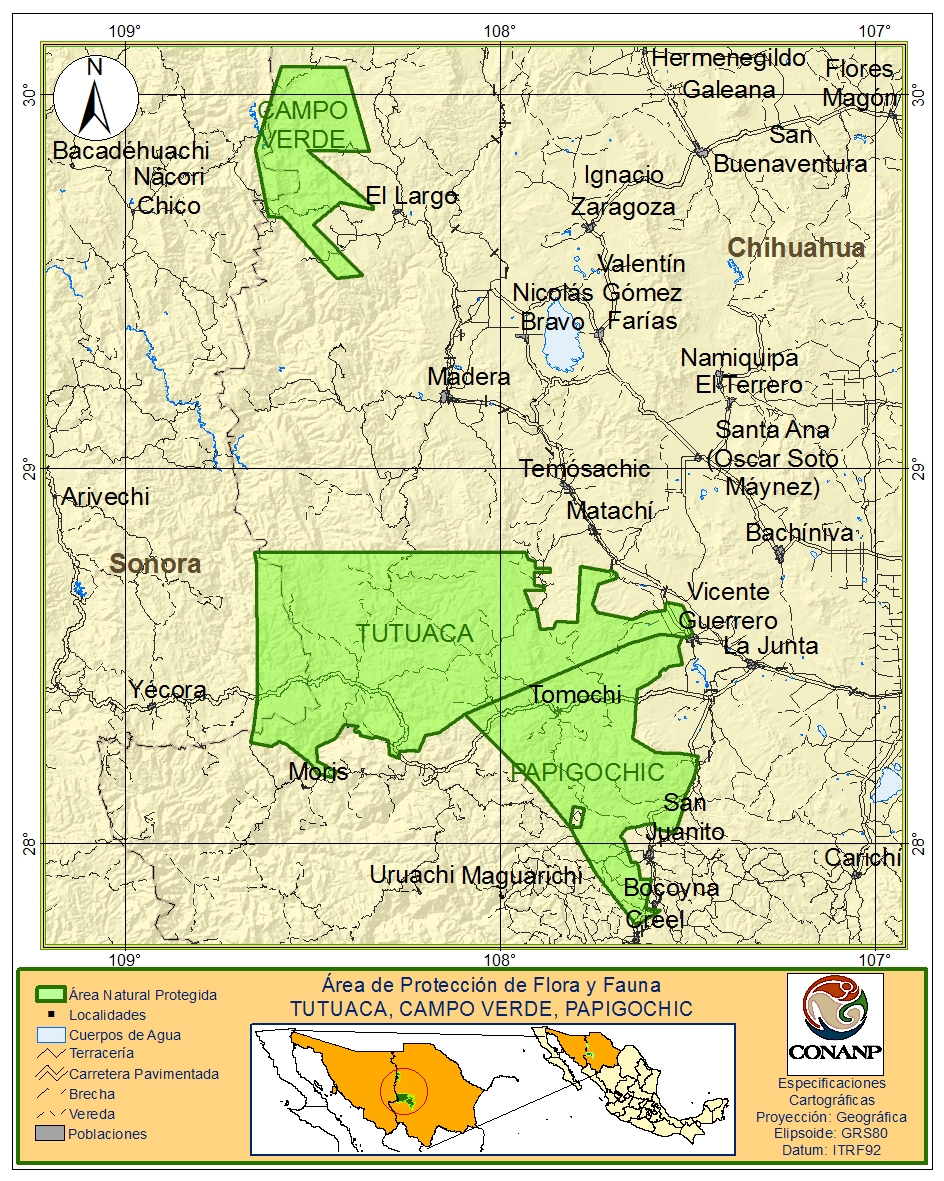 Figura 4. Ubicación de las APFF Tutuaca, Campo Verde, Papigochic, RB Janos y RPC Conservación Madera en Chihuahua.
Figura 4. Ubicación de las APFF Tutuaca, Campo Verde, Papigochic, RB Janos y RPC Conservación Madera en Chihuahua.
El monitoreo se realizó de julio a octubre, rango que comprende la actividad reproductiva de la especie. Se dio seguimiento a la situación actual de nidos con registros históricos desde 1996, anotando el estado de utilización en que se encontraron: activo, inactivo, dormidero. Una cavidad se definió como nido a partir de criterios donde se observaron huevos o pollos, restos de alimento bajo el árbol-nido o la observación directa del ave. Así mismo, se consideró activa si tenían características de acondicionamiento por parte de la especie, esto se verificó mediante visitas periódicas a los nidos y al observar que un individuo adulto entraba y salía de la cavidad al menos tres veces en un periodo de diez días. Debido a que la especie es gregaria y sus estructuras de anidación pueden ser usadas año tras año, durante los recorridos para el registro de las cotorras se utilizaron dos técnicas: búsqueda y espera. En el primer caso, durante junio, se realizaron búsquedas intensivas de nidos mediante recorridos de observación. En este período las parejas reproductoras están activas inspeccionando cavidades, hay una intensa actividad con fuertes vocalizaciones y conductas de cortejo de las parejas sobre los árboles-nido, lo que permite localizar rápidamente la ubicación de los nidos. Así mismo, se realizaron búsquedas intensivas a la espera, que consistió en postrarse en un sitio con amplia visibilidad por un día y esperar a oír las vocalizaciones de las cotorras en los nidos y localizarlas con binoculares. También se esperaba el arribo de adultos que llegaban de las secciones de alimentación emitiendo fuertes vocalizaciones, una vez que se identificó el área de arribo o el árbol-nido, se procedió a la toma de datos. Después de permanecer un día completo en el área, se visitaron otros sitios. Para la identificación de las cavidades activas se siguieron los criterios del Cuadro 1.
En cuanto a la fenología de los árboles-nidos, una vez detectados se etiquetaron con una clave de identificación única y se tomaron datos como especie, diámetro a la altura del pecho (DAP), altura, coordenadas, altura sobre el nivel del mar, pendiente, entre otros (Figura 5).
Cuadro 1. Criterios para determinar la actividad de R. pachyrhyncha en cavidades de árboles.
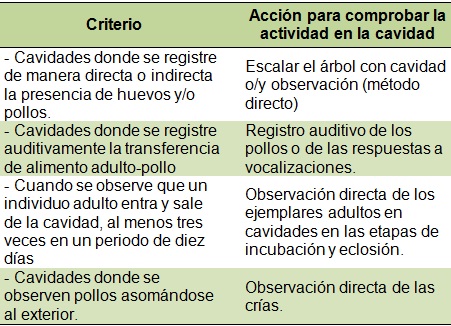
 Figura 5. Medición del diámetro a la altura del pecho (DAP) de un árbol nido para su caracterización fenológica.
Figura 5. Medición del diámetro a la altura del pecho (DAP) de un árbol nido para su caracterización fenológica.
Los árboles usados para anidar se agruparon en tres categorías cualitativas dependiendo de su condición: 1) Árbol vivo (árboles mayores de 0.40 cm de DAP y sin evidencias de deterioro), 2) árbol deteriorado (árboles sobremaduros, con evidencias claras de deterioro por la edad, ramas superiores muertas o despuntados y 3) árboles secos o muertos, asumiéndose que su muerte ocurrió de forma natural por la edad y teniendo alguna o varias de estas características: fustes con o sin corteza o desgajada, incluso podridos o a punto de caer (Figura 6). También se registraron otros indicios de actividad como bebederos, dormideros, sitios de alimentación y percha, donde se tomaron los siguientes datos: ubicación geográfica, altitud, DAP, especies utilizadas, exposición, altura de cuerpos de agua y número de individuos observados. Una vez localizados los sitios de perchas, bebederos y dormideros se realizaron conteos sistemáticos por arribo en cada sitio, esto se realizó mensualmente para obtener un promedio de individuos por ANP. Respecto al monitoreo de la anidación, se escalaron los árboles accesibles y se registró el tamaño de puesta, tamaño de nidada y número de volantones exitosos que en algunos casos se les tomaron medidas morfométricas y se revisó su estado general (Figura 7).
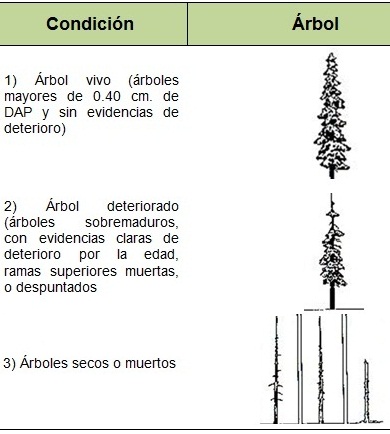 Figura 6. Categorías cualitativas de los árboles usados dependiendo de su condición.
Figura 6. Categorías cualitativas de los árboles usados dependiendo de su condición.
 Figura 7. Toma de medidas morfométricas de un volantón.
Figura 7. Toma de medidas morfométricas de un volantón.
Para poder comparar variables como tamaño de nidada, proporción de huevos eclosionados, proporción de huevos no eclosionados y proporción de volantones por huevo entre las diferentes áreas se llevaron a cabo cuatro análisis de varianza de una vía (α=0.05), uno para cada variable, cuando se rechazó la hipótesis nula de igualdad se llevaron a cabo pruebas de Tukey. Para comparar las proporciones de huevos eclosionados (número de huevos eclosionados/número total de huevos puestos), de volantones en relación a los eclosionados (número de volantones/número de huevos eclosionados) y de volantones en relación a los huevos puestos (número de volantones/número de huevos puestos) para los diferentes años se llevaron a cabo tres análisis de varianza de una vía (α=0.05), uno para cada variable, cuando se rechazó la hipótesis nula de igualdad se llevaron a cabo pruebas a posteriori de Duncan. Para comparar la frecuencia de nidos considerando la especie de árbol (sin importar su estado) y su estado (vivo o muerto), entre el presente estudio y los trabajos de Lanning y Shiflett (1983) y Monterrubio et al (2002) se llevaron a cabo, para cada caso, análisis de independencia Ji2 (α=0.05). También se comparó el diámetro de los árboles utilizados para anidar y para cada caso se realizó una prueba de hipótesis de diferencia entre las media de dos poblaciones (α=0.05). En el caso de los árboles que no pudieron ser escalados, se utilizó una sonda de madriguera (cámara de video), con la que se visualizó el interior de las cavidades, ya sea desde el suelo o escalando el árbol contiguo al árbol-nido. En los casos donde ninguna de las opciones anteriores fueron viables se realizó el monitoreo de manera indirecta (registro visual y/o auditivo con presencia/ausencia de actividad en cada visita al nido). Con estos datos se obtuvo información sobre la reproducción y reclutamiento de cada sitio de anidación y para la población en general, además de determinar el éxito reproductivo promedio e índices de mortalidad y supervivencia de nidadas. Para determinar la productividad de las colonias de anidación se tomó en cuenta el número total de nidos, número total de huevos, total de huevos eclosionados y total de volantones producidos. El éxito de anidación fue el porcentaje estimado tomando en cuenta la inversión reproductiva registrada y la producción final de las nidadas, es decir, el tamaño de la puesta con respecto a la producción de volantones. Se evaluó el índice de mortalidad, obteniéndolo mediante la tasa de supervivencia diaria, registrando en cada visita el número de pollos presentes en el nido a lo largo de su desarrollo y las posibles disminuciones en el número de crías en relación al número de días que se estuvo monitoreando el nido. Este método determinó el valor de la tasa de supervivencia, que es lo contrario a la tasa de mortalidad. Para la localización de sitios de alimentación, perchas, bebederos y dormideros se rastreó a los individuos que en 2010 se les colocaron radiocollares en el APFF Tutuaca y la RPC Madera. El peso de los transmisores fue de 20 g (Model AI-2C, antena circular) y representaban el 4.3 % del promedio del peso de las cotorras, con una vida útil de 24 meses. Se utilizaron receptores modelo TRX-2000S con antena yagi de tres elementos. Los individuos rastreados por telemetría fueron seguidos diariamente, estableciendo rutas mediante la triangulación de dos receptores. Una vez triangulado, se visitó el área hasta que se ubicó al ejemplar. Una vez localizado se realizaron los conteos sistemáticos por arribo observando la actividad que realizaban y se caracterizó el hábitat. Se trabajó en parcelas de vegetación con un radio de 17.8 m, tomando como centro los arboles utilizados para alimentación, percha o dormidero.
Resultados: Se presentan los datos obtenidos sobre tendencias poblacionales y distribución de la especie.
Nidadas. La mayoría de los huevos en las APFF Tutuaca, Papigochic, Campo Verde y la RB Janos fueron puestos entre el 7 y 16 de julio, coincidiendo con lo reportado en la literatura (Lanning y Shiflett 1983, Monterrubio et al 2002). En la RPC Madera se registró un desfasamiento significativo en los inicios y finales de posturas de hasta de 20 días, iniciando las posturas a principios de julio, finalizando a inicios de septiembre. Como es típico en los psitácidos, la incubación la realizan por completo las hembras y se inicia con la puesta del primer huevo. El promedio de huevos por nido fluctuó entre 2.3 y 2.8 en las diferentes ANP. El periodo de incubación tuvo una duración promedio de 26 días. La eclosión fue asincrónica y los pollos rompieron el cascarón a intervalos de días. La eclosión de los huevos dentro de una misma nidada, ocurrió por lo general a intervalos de dos días. Los pollosal eclosionar están totalmente cubiertos de plumón blanco y abren los ojos a la semana de nacimiento.
El peso promedio de los recién nacidos fue de 12.7 gramos (0.51 ES) con un rango de 9.5-14.1 g. La longitud de la cuerda alar fue de 10 a 12 mm. En cuanto a la proporción de huevos eclosionados, esta fluctuó entre 0.72 y 0.91, no encontrándose diferencias significativas entre las diferentes ANP. Al analizar la proporción de los huevos no eclosionados se observó una fluctuación entre 0.00 y 0.28, es decir, en el mejor de los casos (APFF Campo Verde) eclosionaron todos los huevos y en el otro extremo (RPC Madera) el 28% fueron infértiles. Respecto a la proporción de volantones por huevo esta variable fluctuó entre 0.65 y 0.81, las diferencias no pueden ser consideradas significativas, es decir, en todas las ANP se produjo la misma proporción de volantones/huevo.
Productividad de nidos. Se evaluó el éxito reproductivo de 47 nidos durante toda la etapa reproductiva, esto representa el 30.3 % del total de las parejas reproductoras localizadas en las cinco ANP. Se dio seguimiento a la actividad reproductiva desde el cortejo hasta el vuelo de los volantones. En total se observaron 128 huevos (2.7 huevos / nido ± 0.85), de los cuales 101 huevos eclosionaron (2.1 pollos / nido) y 88 juveniles volaron exitosamente del nido (1.8 volantones / nido ± 0.79) (Anexo I). Se realizó una comparación con datos de los últimos cinco años entre las ANP monitoreadas, el análisis de la proporción de huevos eclosionados indicó que no hubo diferencias significativas entre los diferentes años, la proporción fluctuó entre 0.74 y 0.85 (Figura 8). Respecto a la proporción de volantones por huevos eclosionados el análisis indicó diferencias significativas entre los años de monitoreo (F7, 630=2.837, p=0.006), la proporción fluctúo entre 0.44 y 0.69. Los años con menores valores fueron 1999 y 2000 con menos de un 50% de éxito de volantones, los valores mayores se alcanzaron en 1998, 2001 y 2011 (Figura 9).
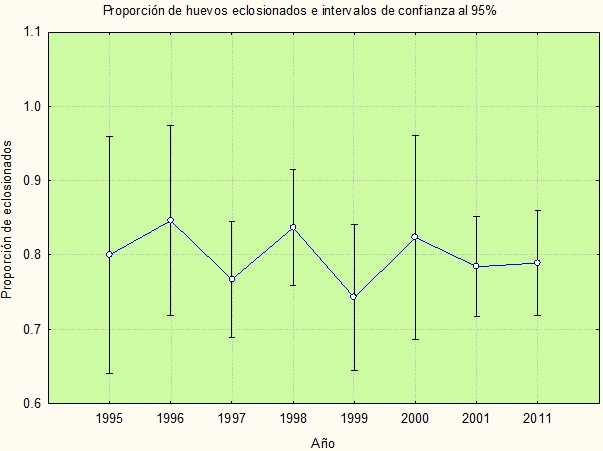 Figura 8. Proporción de huevos eclosionados (número de huevos eclosionados/número total de huevos puestos) de 1995 a 2011.
Figura 8. Proporción de huevos eclosionados (número de huevos eclosionados/número total de huevos puestos) de 1995 a 2011.
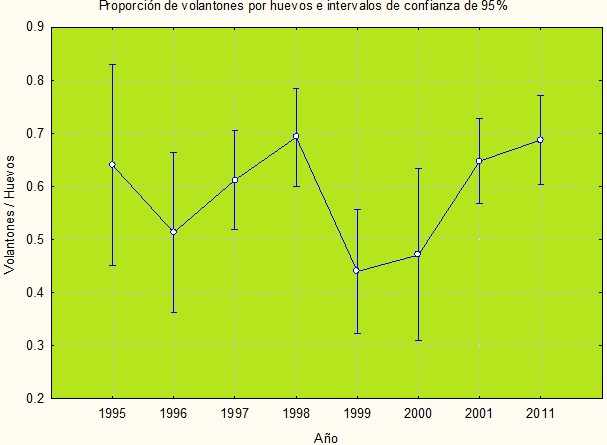 Figura 9. Proporción de volantones por huevo (número de volantones /número de huevos puestos) de 1995 a 2011.
Figura 9. Proporción de volantones por huevo (número de volantones /número de huevos puestos) de 1995 a 2011.
La prueba a posteriori de Duncan formó tres grupos homogéneos, el primero con bajas proporciones compuesto por 1999 y 2000, otros con proporciones altas (1998 y 2011); el resto de los años (1995, 1996, 1997 y 2000) integró un grupo intermedio (Cuadro 2).
Cuadro 2. Grupos homogéneos para la proporción de volantones expresada en relación al total de huevos puestos.
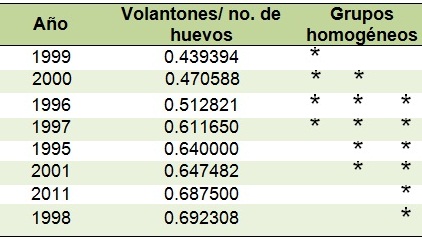
|
Respecto a la proporción de volantones en relación al número de huevos eclosionados, se encontraron diferencias significativas entre los diferentes años (F7,498=4.56, p<0.01). Llama la atención los valores bajos registrados en 1996, 1999 y 2000 (Figura 10).
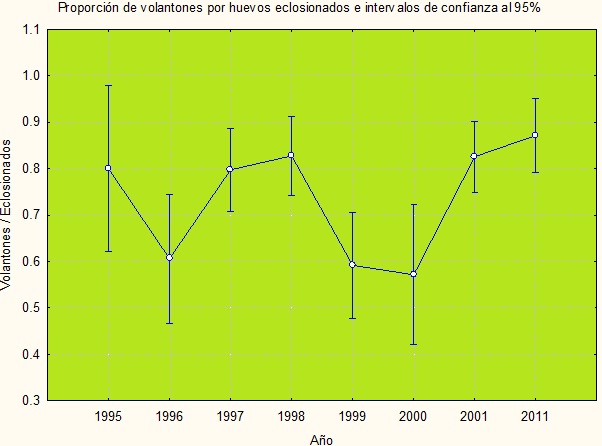
Figura 10. Proporción de volantones en relación a los huevos eclosionados (número de volantones /número de huevos eclosionados) de 1995 a 2011.
La prueba a posteriori de Duncan mostró dos grupos bien diferenciados; el primero compuesto por 2000, 1999 y 1996, con bajas proporciones en volantones (0.57 a 0.60) y el del resto de los años con mayores éxitos (0,79 a 0.87).
Cuadro 3. Grupos homogéneos para la proporción de volantones expresada en relación al número de huevos eclosionados. 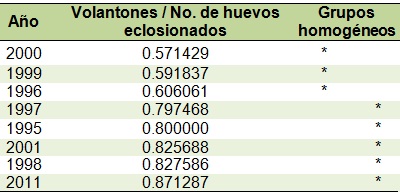
Fenología de los árboles-nido. Durante el monitoreo en las ANP se registraron 177 parejas activas, de las cuales 22 presentaron comportamiento reproductivo. Esto representó el 12.4 % de las parejas, cercano a lo registrado por Cruz-Nieto (1997) quien reportó que el 16.1% de parejas activas tuvieron comportamiento reproductivo. De los 155 nidos registrados, 76 se encontraron en Populos tremuloides (49.6 %),31 enPseudotsuga menziensii (20 %),29 en Pinus ayacahuite (23.06 %),ocho en Pinus duranguensis (5.16 %), cuatro en Abies concolor (2.58 %)y siete utilizaron nidos artificiales (4.51 %) (Figura 11). De las 177 parejas activas en las ANP monitoreadas (Figura 12), 155 alcanzaron la etapa reproductiva, de estas, 47 nidos fueron verificados de forma directa escalando el árbol, 68 mediante la escucha de vocalizaciones de trasferencia de alimento a pollos y 40 por observación directa de volantones asomándose por la cavidad (Figura 13). De los 155 nidos con actividad reproductiva solo se analizaron 148, el resto correspondió a nidos artificiales.
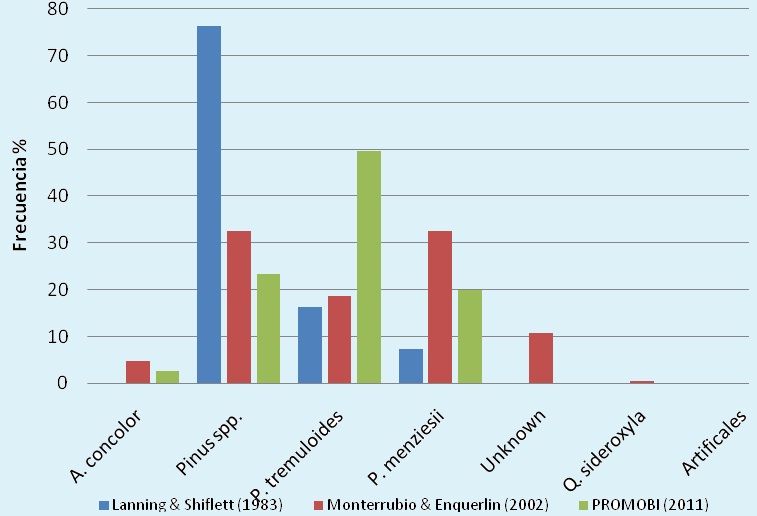 Figura 11. Frecuencia (%) de especies de árboles utilizados para anidar por la cotorra serrana en diferentes estudios.
Figura 11. Frecuencia (%) de especies de árboles utilizados para anidar por la cotorra serrana en diferentes estudios.
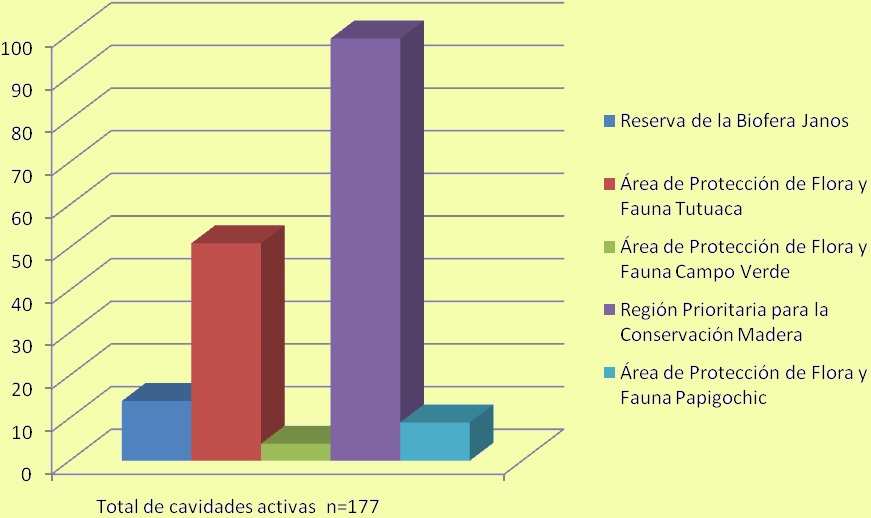 Figura 12. Número de parejas activas por ANP monitoreada.
Figura 12. Número de parejas activas por ANP monitoreada.
 Figura 13. Ejemplar de R. pachyrhyncha observado en su árbol-nido.
Figura 13. Ejemplar de R. pachyrhyncha observado en su árbol-nido.
El porcentaje de árboles muertos utilizados fue de 56.7 % (n=84) y el de árboles vivos 43.2 % (n=64). El 16.1 % de los nidos fueron ubicados en arboles con múltiples nidos, en la RPC Madera se registraron 10 árboles de P. tremuloides con 23 nidos y en el APFF Campo Verde se registraron dos nidos en un P. ayacahuite. El análisis de la frecuencia por especie indicó la existencia de diferencias significativas entre los trabajos anteriores y el presente estudio (Ji212=115.17, p<0.01). Lanning y Shiflett (1983) observaron una gran cantidad de nidos en Pinus spp., Monterrubio et al (2002) obtuvieron un arreglo más variado, mientras que en el presente trabajo los nidos se ubicaron mayormente en P. tremuloides (Figura 14).
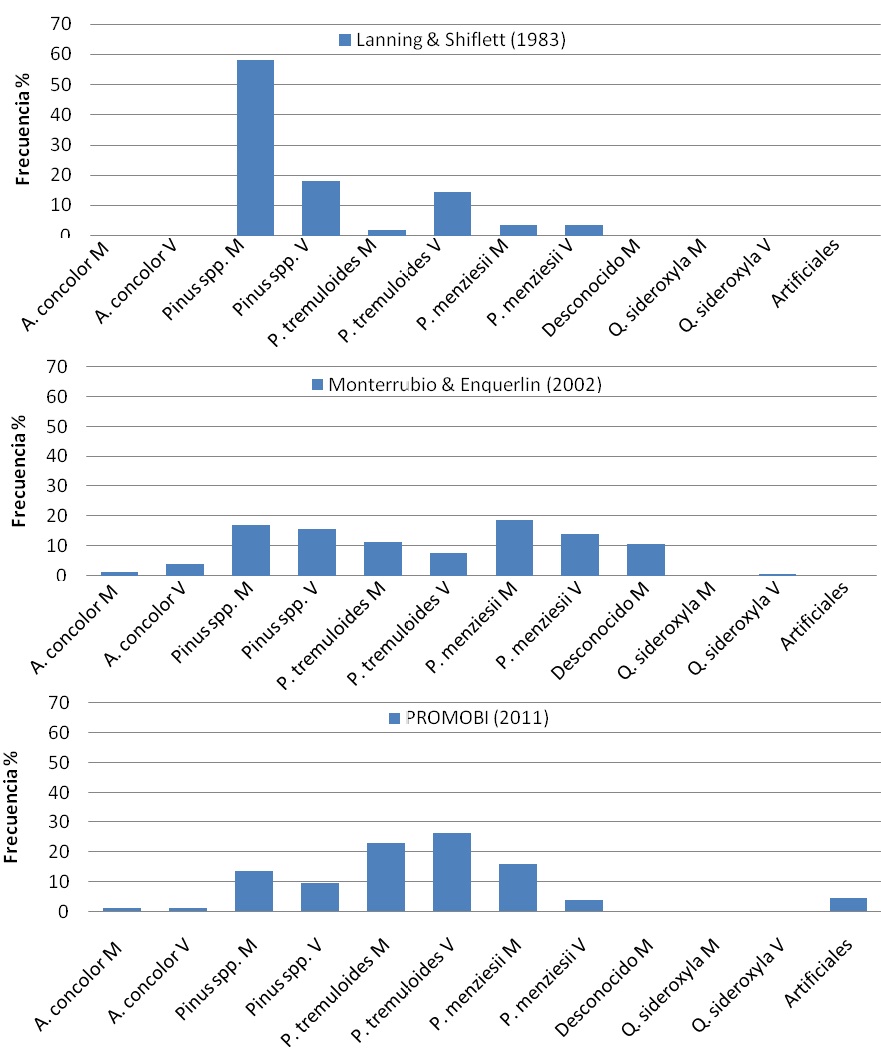 Figura 14. Comparativo de la frecuencia porcentual de utilización de las especies de árboles considerando su estado (M=muertos y V=vivos) de los diferentes estudios.
Figura 14. Comparativo de la frecuencia porcentual de utilización de las especies de árboles considerando su estado (M=muertos y V=vivos) de los diferentes estudios.
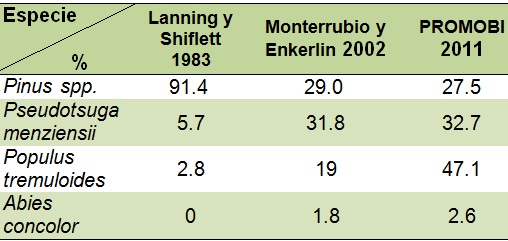
En su trabajo de 1983, Lanning y Shiflett registraron 55 nidos de R. pachyrhyncha, de los cuales 35 se hallaban en árboles muertos, la especie más representativa fue Pinus spp con un 91.4 % (32), P. menziensii 5.71% (2) y P. tremuloides el 2.8 % (1). Así mismo, Monterrubio et al en 2002 observaron 110 nidos en árboles muertos, Pinus spp con un 29 % (32), P. menziensii 31.8 % (35) y P. tremuloides el 19.09 % (21), A. concolor represento el 1.8 % (2). Al comparar estos datos con el monitoreo actual, donde se registraron 84 nidos en árboles muertos, en general se aprecian diferencias en la reducción de arbolado muerto en Pinus spp; las mismas diferencias generales se observan en el incremento en la anidación en árboles muertos de P. tremuloides. (Figura 15, Cuadro 4).
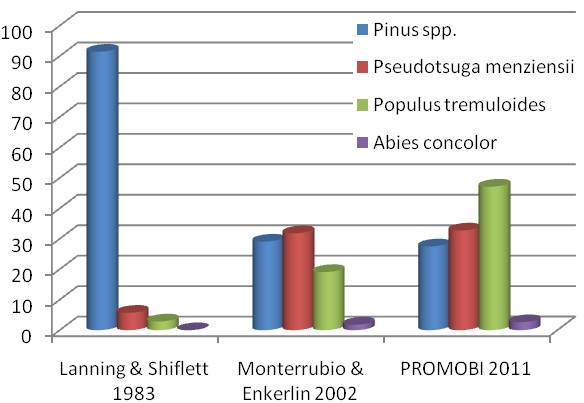 Figura 15. Comparación porcentual entre el presente estudio y trabajos anterios sobre las especies de arbolado muerto para anidacion.
Figura 15. Comparación porcentual entre el presente estudio y trabajos anterios sobre las especies de arbolado muerto para anidacion.
Cuadro 4. Comparación entre estudios respecto a la utilización de arboles muertos para nidos.
De los 155 nidos registrados en 2011, el ANP con mayor cantidad de nidos fue la RPC Madera con 82, de estos 72 se encontraron en P. tremuloides, uno en P. ayacahuite y siete en nidos artificiales. En segundo lugar estuvo el APFF Tutuaca con 48 nidos, 26 en P. ayacahuite, cuatro en A. concolor, siete en P. duranguensis, 10 en P. menziensii y uno en P. tremuloides, que fue el primer registro en el ANP. La tercer ANP con más nidos fue la RB Janos con 13, todos en P. menziensii; le siguió el APFF Papigochi con nueve nidos, siete en P. menziensii, uno en P. duranguensis y el primer registro en el ANP de un nido en P. tremuloides. Finalmente, en el APFF Campo Verde se registraron dos nidos en el mismo árbol de P. menziensii con un nido (Figura 16).
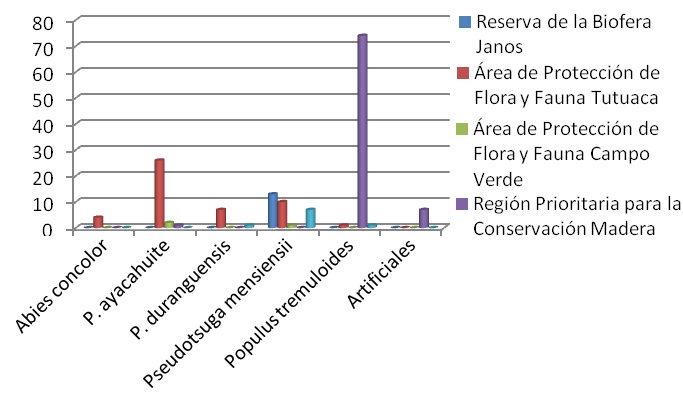 Figura 16. Especies utilizadas como árbol-nido en las diferentes ANP monitoreadas en 2011.
Figura 16. Especies utilizadas como árbol-nido en las diferentes ANP monitoreadas en 2011.
En generalP. tremuloides, P. menziensii y P. ayacahuite fueron las especies predominantes en la anidación. Respecto a la caracterización de los diámetros a la altura del pecho, altura del árbol y del nido, el DAP con mayor proporción en arboles fluctuó entre 40-59 cm (36.4 %), seguido del intervalo 60-79 cm con un 35.1 %, arboles con DAP entre 80-100 cm representaron el 15.5 %, un porcentaje menor fue en arboles con diámetros mayores a 1 m con un 10.8 % (Figura 17).
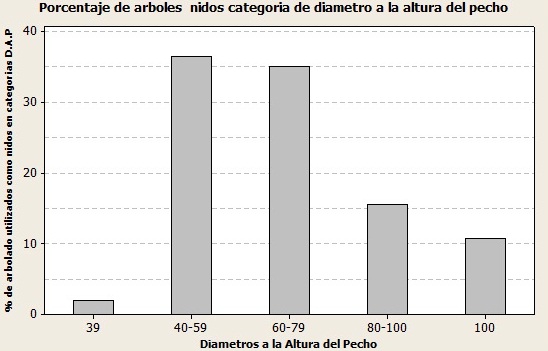 Figura 17. Porcentaje de árboles-nido por categorías de Diámetro a la Altura del Pecho.
Figura 17. Porcentaje de árboles-nido por categorías de Diámetro a la Altura del Pecho.
Las mejores condiciones de estructura del arbolado en las ANP, se reflejan en los DAP, siendo la RB Janos la que mejores condiciones tuvo, en esta reserva se registró un promedio de DAP de 1.06 m, seguida en orden decreciente por la APFF Papigochi (0.93 m), APFF Campo Verde (0.76 m), APFF Tutuaca (0.68 m) y finalmente la RPC Madera con el promedio mas bajo de DAP que fue de 0.59 m. Esto se debe en gran medida a que en la RB Janos todos los nidos se localizaron en P. menziensii, especie de grandes dimensiones (Figura 18). La altura de la entrada a la cavidad del nido vario según la especie de árbol. En promedio fue de 20.4 m desde el suelo, coincidiendo con lo reportado por Monterubio et al (2002) quienes obtuvieron un promedio de altura de 18.2 m en 187 árboles-nidos. El nido más alto se registró en P. menziensii a 35 m en la RB Janos y el nido más bajo se encontró en P. tremuloides en la RPC Madera con 8 m de altura desde el suelo (Figura 19).
 Figura 18. Ejemplar de Pseudotsuga menziesii en la RB Janos, uno de los árboles de mayor tamaño y con más registros de nidos en ellos.
Figura 18. Ejemplar de Pseudotsuga menziesii en la RB Janos, uno de los árboles de mayor tamaño y con más registros de nidos en ellos.
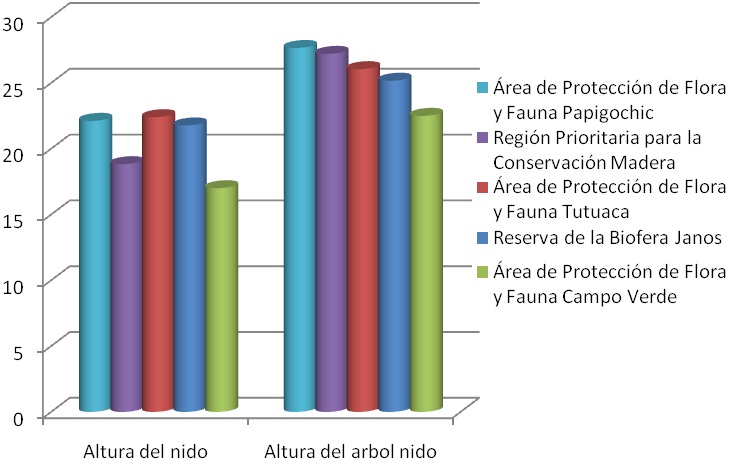 Figura 19. Alturas de arboles y nidos en las ANP monitoreadas en 2011.
Figura 19. Alturas de arboles y nidos en las ANP monitoreadas en 2011.
Distribución de la especie y sus nidos. De 1995 a 2011 se han realizado búsquedas de nidos y actividad de la cotorra serrana occidental en sitios históricos de registros (Lanning y Shiflett 1983, Lammertink 1996). Con base en estos datos y los resultados del actual estudio, es posible afirmar que las zonas de distribución y anidación de R. pachyrhyncha, se localizan desde las coordenadas geográficas extremas N 30º 33’ 39’’, W 108º 38’ 26’’ en la RB Janos hasta el APC Cerro de Mohinora y sur de Durango en la localidad conocida como Cócono en las coordenadas N 25° 57´ W 106° 21´. La especie persiste en bajas proporciones en los ejidos 5 de Mayo y Altamirano en las áreas de influencia entre la RB Janos y el APFF Campo Verde en los Ejidos las Playas, Propiedad Privada El Apache y Agua Salada, Los Azules y el Poleo.
Tendencia poblacional. Mediante conteos sistemáticos por arribos en bebederos, donde la concentración de individuos es mayor (Figura 20), se realizó una estimación poblacional para cada una de las áreas estudiadas.
 Figura 20. Un bebedero comunitario en la comunidad de Heredia en el APFF Papigochic.
Figura 20. Un bebedero comunitario en la comunidad de Heredia en el APFF Papigochic.
El APFF Papigochic tuvo el mayor número de registros con un total de 750 individuos, seguida del APFF Tutuaca con 450 y la RPC Madera con 430. El total de individuos registrados en las cinco áreas de estudio fue de 1, 760. Cabe señalar la importancia de que en el APFF Papigochic se encuentre una población importante no reproductiva, aun cuando las condiciones del hábitat se encuentran degradadas, principalmente por incendios forestales. Los mejores arboles nidos en cuanto diámetro y altura fueron localizados en la RB Janos, con una población reproductiva del 7.9 %. El área con los menores DAP y densidades de nidos fue el APFF Campo Verde y su área de influencia. La RPC Madera registró la mayor población reproductiva (55.9 %), sin embargo, tuvo la tasa de reclutamiento de juveniles más baja respecto a las otras áreas.
Rango Hogareño. Se documentaron las distancias diarias recorridas a las áreas de alimentación, encontrando que varían entre los tipos de vegetación existentes. El promedio de movimiento diario fue de 49.7 km, en cinco sesiones, utilizando los recursos existentes por tipo de vegetación. Para la primer sesión de alimentación recorrieron una distancia promedio de 16 km a zonas con Pinus cembroides, en la segunda sesión, recorrieron 2.7 km a macizos de Pinus arizonica y bosques mixtos de Pseudotsuga menziesii y P. ayacahuite. En la tercera sesión de alimento utilizaron la asociación de P. engelmanni- Pinus chihuahuana a una distancia promedio de 8.8 km de las áreas de anidación. Para la cuarta sesión recorrieron una distancia promedio de 10.7 km a zonas con P. engelmanni. Al bebedero, como única sesión, recorrieron una distancia de 11.3 km.En general el promedio de distancia a las áreas de alimentación fue de 9.7 km ± 6.1 km.
Discusión y Conclusiones: Actualmente la población de cotorra serrana occidental se estima en no más de 5, 000 individuos. No obstante, se está trabajando para llevar a cabo un conteo sistemático de la población debido a lo amplio de su distribución, por lo que no existe un parámetro confiable de su tamaño poblacional (Enkerlin-Hoeflich et al 1998). Es importante considerar, en futuros monitoreos, otros sitios donde se tiene reportes de la especie como en Sierra del Nido, en la propiedad privada de Parapetos y en Namiquipa; también entre el APFF Tutuaca y la RPC Madera en el Ejido el Largo en la localidad del cerro Salsipuedes. La población estimada en 1954 era de 1, 000-4, 000 individuos y 5, 000 en 1992. En 2004, la población estimada fue de 3, 000-6, 000 individuos incluyendo 2, 800 juveniles. Basado en la información de productividad y conteos sistemáticos a parvadas realizados de 1998 hasta 2011 se puede concluir que las ANP monitoreadas mantienen casi el 50 % de la población total reportada en la literatura.
Los incendios y la extracción forestal han reducido el rango de distribución histórico de la especie, a pesar de presentar niveles altos de productividad. Otro aspecto por lo que la especie encuentra pocos sitios disponibles de anidación es la trasformación de bosques heterogéneos a homogéneos, donde la edad máxima para su aprovechamiento forestal es de 180 años, cuando las cotorras requieren edades de arbolado de 326 años en promedio. El que un 16.1 % del total de registros de nidos se hayan realizado en arboles con múltiples nidos, la pronta aceptación de cajones artificiales (4.5 %), los diámetros a la altura del pecho más bajos y la utilización hasta del 86 % de una sola especie de árbol es evidencia de poca disponibilidad de áreas de anidación y una perdida a gran escala del hábitat de la especie.
Las problemáticas de la conservación de las áreas de anidación de R. pachyrhyncha son varias, dentro de las cuales los disturbios antropogénicos tienen gran influencia. Derivado de esto se han identificado algunos procesos fundamentales en la conservación de esta especie y su hábitat. La participación de ejidos, comunidades y habitantes de estas zonas es de gran importancia, se deben valorar los sus recursos y obtener de ellos fuentes alternativas de empleo y mejora de la calidad del medio ambiente.


|

 Figura 1. Ejemplar de R. pachyrhyncha en el Área de Protección de Flora y Fauna Tutuaca.
Figura 1. Ejemplar de R. pachyrhyncha en el Área de Protección de Flora y Fauna Tutuaca. Figura 2. Bandada de cotorras serranas occidentales.
Figura 2. Bandada de cotorras serranas occidentales. Figura 3. Bosque maduro de coníferas, hábitat característico de R. pachyrhyncha en la Sierra Madre Occidental.
Figura 3. Bosque maduro de coníferas, hábitat característico de R. pachyrhyncha en la Sierra Madre Occidental. Figura 4. Ubicación de las APFF Tutuaca, Campo Verde, Papigochic, RB Janos y RPC Conservación Madera en Chihuahua.
Figura 4. Ubicación de las APFF Tutuaca, Campo Verde, Papigochic, RB Janos y RPC Conservación Madera en Chihuahua.
 Figura 5. Medición del diámetro a la altura del pecho (DAP) de un árbol nido para su caracterización fenológica.
Figura 5. Medición del diámetro a la altura del pecho (DAP) de un árbol nido para su caracterización fenológica. Figura 6. Categorías cualitativas de los árboles usados dependiendo de su condición.
Figura 6. Categorías cualitativas de los árboles usados dependiendo de su condición. Figura 7. Toma de medidas morfométricas de un volantón.
Figura 7. Toma de medidas morfométricas de un volantón. Figura 8. Proporción de huevos eclosionados (número de huevos eclosionados/número total de huevos puestos) de 1995 a 2011.
Figura 8. Proporción de huevos eclosionados (número de huevos eclosionados/número total de huevos puestos) de 1995 a 2011. Figura 9. Proporción de volantones por huevo (número de volantones /número de huevos puestos) de 1995 a 2011.
Figura 9. Proporción de volantones por huevo (número de volantones /número de huevos puestos) de 1995 a 2011.


 Figura 11. Frecuencia (%) de especies de árboles utilizados para anidar por la cotorra serrana en diferentes estudios.
Figura 11. Frecuencia (%) de especies de árboles utilizados para anidar por la cotorra serrana en diferentes estudios. Figura 12. Número de parejas activas por ANP monitoreada.
Figura 12. Número de parejas activas por ANP monitoreada. Figura 13. Ejemplar de R. pachyrhyncha observado en su árbol-nido.
Figura 13. Ejemplar de R. pachyrhyncha observado en su árbol-nido. Figura 14. Comparativo de la frecuencia porcentual de utilización de las especies de árboles considerando su estado (M=muertos y V=vivos) de los diferentes estudios.
Figura 14. Comparativo de la frecuencia porcentual de utilización de las especies de árboles considerando su estado (M=muertos y V=vivos) de los diferentes estudios. Figura 15. Comparación porcentual entre el presente estudio y trabajos anterios sobre las especies de arbolado muerto para anidacion.
Figura 15. Comparación porcentual entre el presente estudio y trabajos anterios sobre las especies de arbolado muerto para anidacion.
 Figura 16. Especies utilizadas como árbol-nido en las diferentes ANP monitoreadas en 2011.
Figura 16. Especies utilizadas como árbol-nido en las diferentes ANP monitoreadas en 2011. Figura 17. Porcentaje de árboles-nido por categorías de Diámetro a la Altura del Pecho.
Figura 17. Porcentaje de árboles-nido por categorías de Diámetro a la Altura del Pecho. Figura 18. Ejemplar de Pseudotsuga menziesii en la RB Janos, uno de los árboles de mayor tamaño y con más registros de nidos en ellos.
Figura 18. Ejemplar de Pseudotsuga menziesii en la RB Janos, uno de los árboles de mayor tamaño y con más registros de nidos en ellos. Figura 19. Alturas de arboles y nidos en las ANP monitoreadas en 2011.
Figura 19. Alturas de arboles y nidos en las ANP monitoreadas en 2011. Figura 20. Un bebedero comunitario en la comunidad de Heredia en el APFF Papigochic.
Figura 20. Un bebedero comunitario en la comunidad de Heredia en el APFF Papigochic.
