INTRODUCCIÓN
El manejo de los recursos naturales implica la necesidad del conocimiento de la riqueza biológica y por consecuencia, el conocimiento de las condiciones en que se encuentran las poblaciones naturales que integran los ecosistemas. Actualmente el manejo y conservación de la biodiversidad enfrentan retos que inciden de manera negativa sobre su viabilidad. La disminución drástica de las especies debido a la práctica exhaustiva de actividades productivas, urbanización, contaminación, comercio ilegal de flora y fauna, pérdida de conocimiento sobre la naturaleza y políticas erróneas agravan en conjunto los problemas ambientales y el uso de los recursos. Por lo anterior, es necesario que los manejadores de las áreas naturales protegidas (ANP) conozcan la diversidad y el estado de las poblaciones silvestres para poder tomar decisiones acerca de su uso potencial y de su protección. Una de las acciones más importantes para lograr esto, es realizar muestreos de especies que permitan estimar sus poblaciones. Las especies focales son de gran utilidad para planear y manejar ANP debido a que sus necesidades de sobrevivencia representan importantes factores para mantener óptimas condiciones ecológicas y ecosistemas sanos. De acuerdo a este esquema, en la Reserva de la Biosfera La Encrucijada (REBIEN) se han catalogado como organismos indicadores de la calidad del hábitat, entre otras especies, a el cocodrilo de río (Crocodylus acutus) y el caimán (Caiman crocodilus fuscus) (Figuras 1 y 2). Ambas especies se encuentran Sujetas a Protección Especial en la NOM-059-SEMARNAT-2010, por lo que para su monitoreo resulta imperante generar información sobre su estatus poblacional. Los Crocodylia cumplen funciones de suma importancia dentro de sus ecosistemas, por lo son considerados especies clave; el solo hecho de su presencia en un área y el desempeño de sus actividades diarias no solo influyen en la trayectoria de las poblaciones locales de otras especies, sino que también pueden modificar el aspecto y la dinámica del ambiente, desde la estructura del paisaje hasta los flujos hídricos locales (Sánchez-Herrera et al 2011). Por ejemplo, sus desplazamientos cotidianos mantienen abiertos canales secundarios lo que propicia la mezcla y el flujo libre de las aguas y en ciertos entornos, las excavaciones que efectúan los cocodrilos cerca de las riberas pueden promover la permanencia de charcas, las cuales resultan cruciales para otras formas de vida, especialmente en ambientes sometidos a períodos de sequía (Naiman y Rogers 1997).
 Figura 1. Ejemplar de cocodrilo de río (Crocodylus acutus) en la Reserva de la Biosfera La Encrucijada.
Figura 1. Ejemplar de cocodrilo de río (Crocodylus acutus) en la Reserva de la Biosfera La Encrucijada.
 Figura 2. Ejemplar de caimán (Caiman crocodilus fuscus) asoleándose en la Reserva de la Biosfera La Encrucijada.
Figura 2. Ejemplar de caimán (Caiman crocodilus fuscus) asoleándose en la Reserva de la Biosfera La Encrucijada.
Por otro lado, son depredadores muy eficaces, por lo que su presencia tiene un efecto directo en la regulación homeostática de las poblaciones de muchas especies, acuáticas y terrestres (Bondavalli y Ulanowicz 1999). C. acutus y C. c. fuscus, junto con el jaguar (Panthera onca) representan los niveles más altos dentro de las cadenas tróficas de los humedales costeros de la REBIEN y son indicadores de la salud de los ecosistemas de transición tierra-agua. Además, pueden proveer beneficios económicos a las comunidades rurales que habitan en sus zonas de distribución. Abadía (2002) determinó que el valor ecoturístico de C. acutus supera en gran proporción su valor comercial por medio de la piel, por lo que la perdida de los cocodrilos reduce el valor de los humedales (Ross 1995). El grupo posee una serie de adaptaciones ambientales que le ha permitido sobrevivir millones de años, el hábitat en que se encuentran, sus características estructurales para la alimentación, su manera de capturar a las presas, el complejo comportamiento social que exhiben, su reproducción entre otras características ha variado muy poco (Ross y Garnett 1992). Como sucede con la mayoría de las especies de cocodrilos la destrucción del hábitat, la explotación de sus pieles, la cacería indiscriminada y artes de pesca no permitidos han mermado sus poblaciones en sus áreas de distribución, actualmente sobreviven en poblaciones aisladas donde la destrucción de su hábitat y su explotación no han sido tan severas (Álvarez del Toro y Sigler 2001).
Características ambientales de la zona: La Reserva se ubica en la costa de Chiapas, en la región fisiográfica de la Planicie Costera del Pacifico. Abarca los municipios de Pijijiapan, Mapastepec, Acapetahua, Villa Comaltitlán, Huixtla y Mazatán (Figura 3).
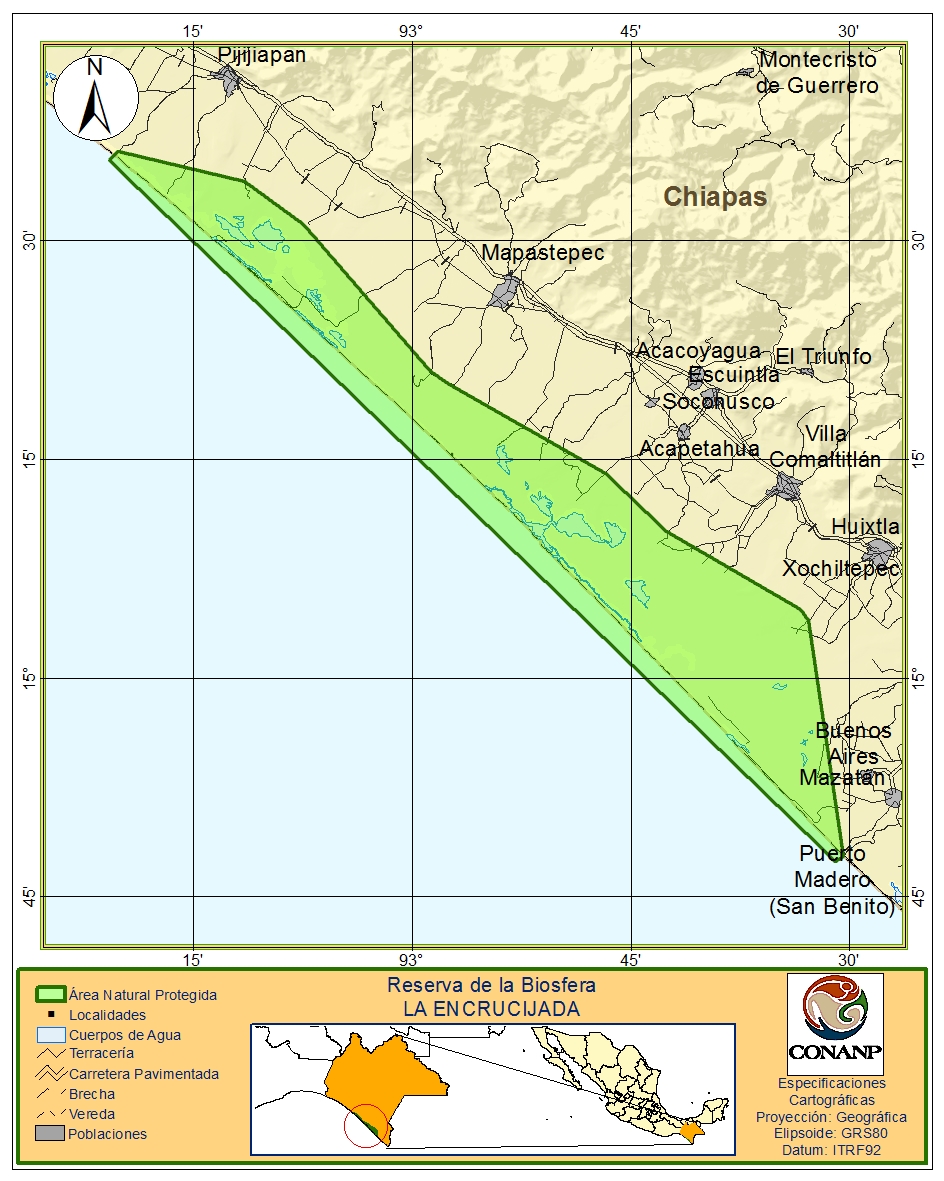 Figura 3. Localización de la Reserva de la Biosfera La Encrucijada en la costa sur de Chiapas.
Figura 3. Localización de la Reserva de la Biosfera La Encrucijada en la costa sur de Chiapas.
Cuenta con 144, 868-15-87.5 ha, de las cuales 36, 216-42-50 corresponden a las zonas núcleo La Encrucijada y Palmarcito, el resto corresponde a zonas de amortiguamiento (INE-SEMARNAP 1999). El clima es del tipo Am(w) cálido-húmedo, con abundantes lluvias en verano. La temperatura media anual es de 28 ° C.
Características biológicas de la zona: La vegetación es característica de humedales costeros, siendo de importancia los bosques de mangle con cinco especies: Rizophora magle, R. harrisonii, Avicennia germinans, Laguncularia rasemosa, Conocarpus erectus y el único bosque de zapotonales (Pachira acuatica) de Mesoamérica, además de tulares, popales, matorral costero, palmares, selva mediana y baja, vegetación flotante y subacuática. La gran diversidad de ambientes en el área, conjuntamente con su privilegiada situación geográfica, en el corredor que une el norte del continente con el centro y sur del mismo provoca que se encuentre en ella una gran riqueza faunística (INE-SEMARNAP 1999), destacando varias especies que se encuentran bajo categorías de riesgo en la NOM-059-SEMARNAT-2010. El ANP se encuentra integrando dos sistemas lagunares: Carretas-Pereyra y Chantuto-Panzacola, áreas de interés biológico y socioeconómico, por su riqueza y biodiversidad y elevada producción de recursos pesqueros. El área de monitoreo se encuentra dentro del sistema lagunar Chantuto-Panzacola.
MONITOREO
Debido a los diferentes factores que están afectando la viabilidad y conservación de los cocodrilianos, el objetivo del programa de monitoreo fue evaluar la situación actual de las poblaciones de C. acutus y C. c. fuscus en la Reserva de la Biosfera La Encrucijada; esto mediante la estimación de su abundancia relativa, patrones de distribución espacial, distribución de tallas y patrones de cambio en ambas poblaciones.
Metodología: El área de muestreo se estableció dentro del sistema lagunar Chantuto–Panzacola que está conformado por cinco lagunas principales (Chantuto, Campón, Teculapa, Cerritos y Panzacola), una boca de comunicación con el mar conocida como San Juan y un largo cordón estuárino paralelo a la barrera arenosa llamado El Hueyate, con una extensión de 18, 000 ha. Se contemplaron siete transectos previamente establecidos (Cuadro 1) con diferente longitud y que corren a lo largo de los esteros El Hueyate, laguna Teculapa-Cerritos-Panzacola y la desembocadura del río Huixtla y Mazateco, sin embargo, durante el monitoreo 2011 solo se muestrearon cuatro transectos (Figuras 4 y 5).
Cuadro 1. Transectos establecidos en el sistema lagunar Chantuto-Panzacola dentro de la REBIEN.
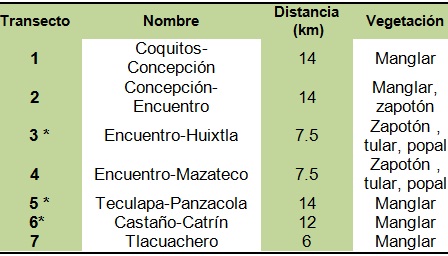 * Transectos que no fueron recorridos en 2011.
* Transectos que no fueron recorridos en 2011.
 Figura 4.
Figura 4. Transecto 1 (Coquitos-Concepción) utilizado para la búsqueda y registro de cocodrilos en la REBIEN.
 Figura 5.
Figura 5. Transecto 2 (Coquitos-Encuentro), otro de los tramos para el registro de cocodrilos.
Para obtener registros de las especies de cocodrilianos se realizaron ocho muestreos entre marzo y noviembre de 2011, cada uno duró tres días y cuatro noches de trabajo efectivo. Los muestreos fueron nocturnos siguiendo el procedimiento sugerido por Messel et al (1981) y adaptado por Thorbjarnarson et al (1992). Cada recorrido se realizó a bordo de una embarcación con motor fuera de borda y a una velocidad de desplazamiento de 10 km/hr. La toma de datos la realizaron un observador (afocador), un anotador, un motorista y una persona de apoyo en caso de capturas. Los censos consistieron en dirigir un haz de luz en busca del brillo de los ojos de los cocodrilos, ya que su sistema visual presenta un tapetum lucidum capaz de actuar como superficie de reflexión de luz hasta en una distancia de 200 m (Figura 6). Se utilizó el método de captura-marcaje-recaptura (Figura 7), el cual resulta de gran utilidad para obtener datos sobre parámetros poblacionales, clases de edades, proporción de sexos, distribución, patrones de movimientos individuales, tasas de crecimiento o supervivencia, además de que se evitan repeticiones en los conteos.
 Figura 6. Búsqueda y detección de los ejemplares a través del reflejo de luz de sus ojos.
Figura 6. Búsqueda y detección de los ejemplares a través del reflejo de luz de sus ojos.
 Figura 7. Marcaje de los ejemplares con grapas metálicas de acuerdo a su talla.
Figura 7. Marcaje de los ejemplares con grapas metálicas de acuerdo a su talla.
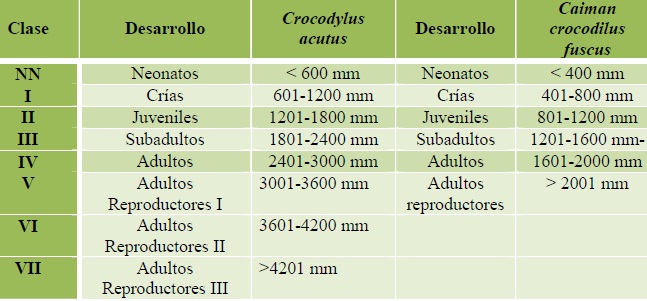
En cada avistamiento se hizo un acercamiento para identificar la especie y estimar su talla acorde a las características observadas; forma del hocico, ojos y coloración en caso de captura. Para la determinación de las tallas y el estado de desarrollo (edad) de los ejemplares se utilizó las clases y claves descritas en el Cuadro 2.
Cuadro 2. Intervalos de talla y grados de desarrollo para C. acutus y C. c. fuscus (Sigler et al 2001).
Adicionalmente, en cada muestreo se tomaron datos sobre como geoposición, temperatura, salinidad del agua, clima, marea, fase lunar, hora, entre otras anotaciones generales. Una vez identificados y estimada su talla, se procedió a su captura mediante técnicas de contención, el procedimiento vario de acuerdo al tamaño del animal (captura manual para ejemplares menores a 700 mm y utilización de lasos y pértigas para organismos mayores a esta talla). Una vez inmovilizados se procedió a la toma de datos biométricos (Figuras 8 y 9). Los parámetros considerados fueron longitud total (LT), longitud hocico-cloaca (LHC), ancho del cráneo (ACR) ancho del cráneo maxilar (ACRMx), longitud del cráneo (LCR) de la placa craneal a la punta del hocico y se contó el numero de escamas cervicales en dirección de la cabeza hacia la cola del ejemplar. La determinación del sexo se realizó mediante palpación. Posteriormente, los organismos fueron liberados en el mismo lugar donde se capturaron. El marcaje y la frecuencia de recaptura de estos individuos, con la aplicación de métodos estadísticos, es una herramienta efectiva para estimar el tamaño de la población. Se espera que dentro de una población grande, el número de cocodrilos recapturados con marcas sea pequeño; pero, si la población es pequeña, se encontraran un mayor número de ejemplares marcados (Brower y Zar, 1979). La estimación se realizó utilizando la siguiente formula:
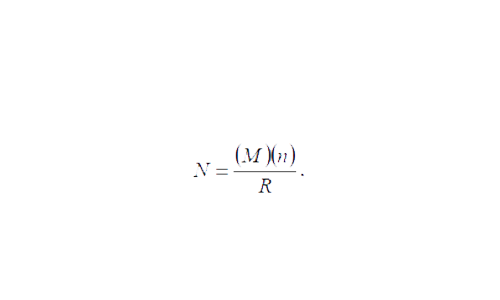
Donde N es el total de la población, M es la muestra de individuos marcados durante el primer muestreo y liberados posteriormente, n es el número total de individuos colectados durante muestreos posteriores (tanto marcados como no marcados) y R es el número de ejemplares recapturados en las siguientes muestras. Para el marcaje se utilizó el método de corte de escamas caudales-quillas (Cocodrilos y caimanes) y grapas interdigitales (solo para cocodrilos). Sin embargo, aún se han obtenido suficientes recapturas para tener una muestra representativa.
 Figura 8.
Figura 8. Toma de medidas morfométricas (ancho interocular) de un ejemplar juvenil capturado.
 Figura 9.
Figura 9. Pesaje de un ejemplar juvenil a bordo de la embarcación.
Abundancia y densidad. Para estimar la abundancia se utilizó la siguiente formula:
Abundancia relativa = Número de registros - NN = ind/km
Distancia recorrida
Donde NN es el número de neonatos.
La densidad se obtuvo considerando la siguiente formula:
Densidad = Número de registros
Km recorridos
Estimación de la población a través del cálculo de la fracción visible de la población. Para la determinación de la fracción que serviría para estimar el tamaño de la población total que fue posible observar se utilizó el método de Messel et al (1981). El método asume que los ejemplares observados representan la fracción visible de la población, ya que existe cierto número que no fue posible observar. De acuerdo con King et al (1990) y Cerrato (1991), la fracción no visible de las poblaciones de cocodrilianos está constituida por dos componentes principales:
1) Animales ubicados en el transecto recorrido que no fue posible observar por estar sumergidos o escondidos,
2) Individuos que se encuentran fuera del área muestreada.
El cálculo de la fracción visible fue propuesto por Messel et al (1981) mediante la siguiente ecuación:
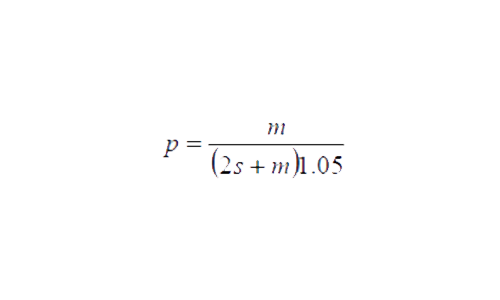
Dónde:
p = porcentaje de la población observada durante un muestreo promedio,
s= desviación estándar y,
m= valor promedio de cocodrilos observados
Una vez calculada la fracción visible, se calculó el tamaño de la población (N) con un límite de confianza del 95%, de acuerdo con la siguiente ecuación:
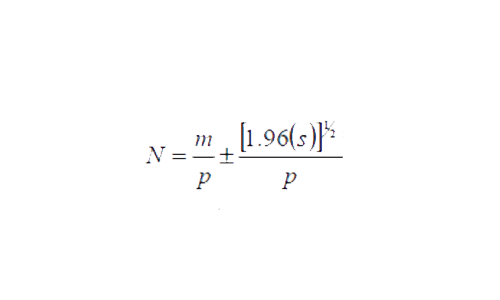
Basado en la formula anterior, el resultado del tamaño poblacional se indica en un rango de variación entre un límite máximo y un mínimo. El procedimiento completo se aplicó para obtener el tamaño de la población por cada transecto y compararlos entre sí.
Resultados: Durante el monitoreo de cocodriliano durante 2011 en la REBIEN se obtuvieron 1, 334 registros de cocodrilianos; 223 (16.7 %) ejemplares de C. c. fuscus, 1, 023 (76.7 %) especímenes de C. acutus y 88 (6.6 %) individuos que no fueron identificados debido a que fueron observados a larga distancia o que sus movimientos de escape fueron muy rápidos (Anexo I). Respecto a la abundancia en promedio se registraron (capturados y observados) 190.6 individuos por mes, siendo mayo y octubre los meses donde se obtuvieron más registros (Figura 10). Durante los meses de muestreo se observa que C. c. fuscus presenta dos picos de alta frecuencia, uno en mayo (70 individuos) y otro en octubre (74 individuos), en cambio C. acutus, aunque también presenta dos picos de abundancia, estos se extienden por varios meses, el primero de marzo a mayo y el segundo de agosto a noviembre.
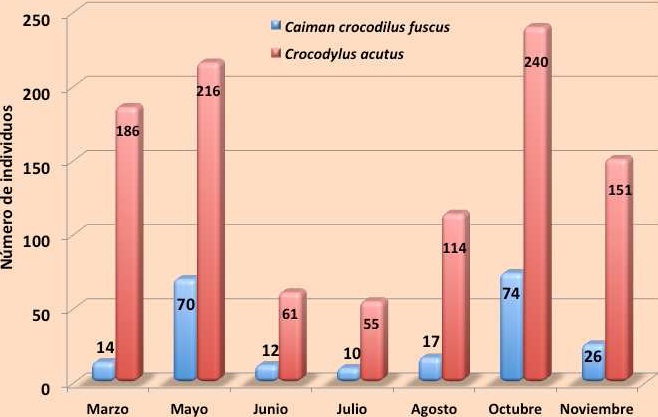 Figura 10.
Figura 10. Frecuencia de registro de individuos de ambas especies en la REBIEN durante 2011.
Los transectos con más registros fueron T1 (Coquitos-Concepción) con 22 y 415 registros y el transecto T5 (Teculapa-Panzacola) con 18 y 325 registros de C. c. fuscus y C. acutus respectivamente en ambos casos. Entre los dos sitios acumularon el 35.6 % de los registros de la primera especie y 26.9 % de la segunda. El transecto menos productivo fue el transecto T6 (Castaño-Catrín), donde se contabilizaron únicamente 160 individuos (73 de C. c. fuscus, 85 de C. acutus y dos individuos indeterminados) (Anexo I, Figura 11).
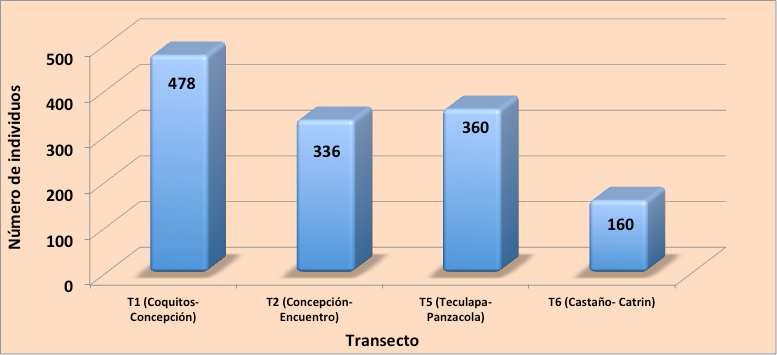 Figura 11. Individuos de cocodrilianos, de ambas especies, registrados en los transectos monitoreados durante 2011.
Figura 11. Individuos de cocodrilianos, de ambas especies, registrados en los transectos monitoreados durante 2011.
Un análisis más detallado de las frecuencias de las dos especies mostró que C. acutus es la especie más abundante en todos los transectos, a excepción del transecto T6 (Castaño-Catrín), donde las frecuencias de avistamiento de ambas especies son similares (Figura 12). Contrario a esto, las frecuencias más altas de C. c. fuscus se encontraron solo en el transecto T2 (Concepción-Encuentro) donde se registró más de una centena de individuos.
|
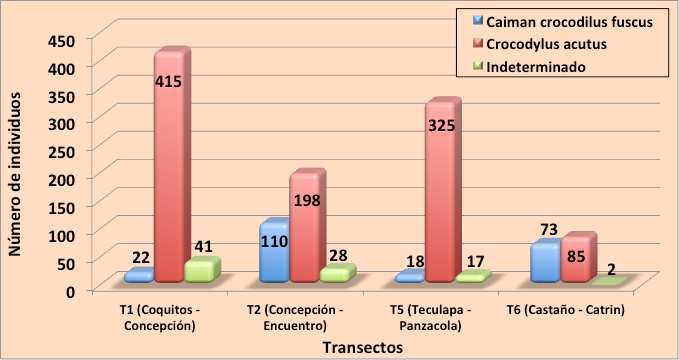 Figura 12.
Figura 12. Frecuencia de observación de C. c. fuscus y C. acutus en los transectos muestreados.
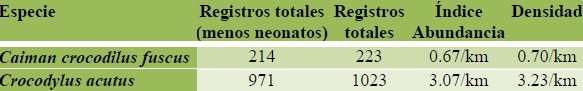
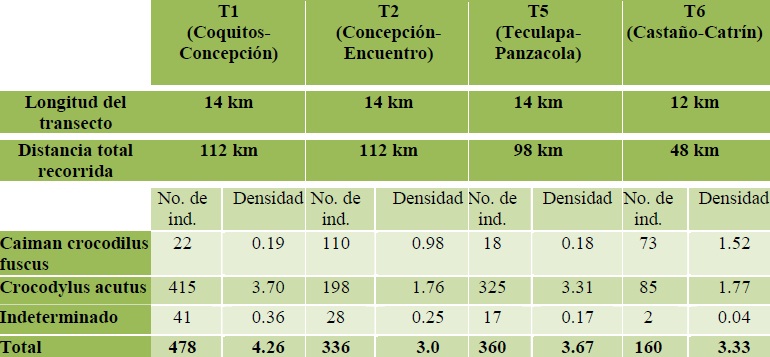
Índices de abundancia y densidad por especie, transecto y a lo largo del año. La abundancia es un atributo de las poblaciones, variable en el tiempo y espacio y de gran importancia en el manejo de fauna silvestre. Estimar la abundancia de una población permite evaluar y comparar su estado a través del tiempo en un área determinada (Garcia et al 2007). La distribución proporcional de cada especie denota su valor e importancia en la comunidad a que pertenece, es decir, medir la abundancia relativa de las especies permite identificar aquellas que por su escasa representatividad son potencialmente más sensibles a perturbaciones ambientales. El índice de abundancia fue considerado como la cantidad de individuos (excepto neonatos; individuos menores de 400 mm para C. c. fuscus y menores de 600 mm para C. acutus) por kilómetro recorrido. La suma de todos los transectos fue de 54 km lineales, por lo que el kilometraje total recorrido durante el monitoreo fue de 316 km. Con estas cifras, la densidad de C. c. fuscus fue 0.70 ind/km recorrido, mientras que para C. acutus fue de 3.2 ind/km, casi cinco veces más que la densidad del caimán (Cuadro 3). Para calcular la densidad se tomaron en cuenta el número total de registros, incluyendo a los neonatos. La mayor densidad de C. c. fuscus se presentó en el transecto T6 (Castaño-Catrin) con 1.52 ind/km y en el transecto T2 (Concepción-Encuentro) con 0.98 ind/km. Respecto a C. acutus la mayor densidad se encontró en el transecto T1 (Coquitos-Concepción) con 3.70 ind/km, siendo el transecto T2 (Concepción-Encuentro) donde se registró la menor densidad de esta especie, con un promedio de 1.76 ind/km (Cuadro 4).
Cuadro 3. Índice de abundancia y densidad poblacional de C. c. fuscus) y de C. acutus en la REBIEN durante 2011.
Cuadro 4. Densidades de C. c. fuscus y C. acutus en los diferentes transectos monitoreados.
A lo largo del año las densidades fluctuaron en ambas especies, la densidad de C. c. fuscus varío poco a lo largo del año y siempre fue menor a dos individuos por kilómetro, sus mayores densidades se registraron en mayo con 1.30 ind/km y en octubre con 1.37 ind/km. En cambio C. acutus tuvo su mayor densidad en marzo con 4.43 ind/km y octubre donde se registraron en promedio 4.44 ind/km (Cuadro 5, Figura 13).
Cuadro 5. Densidades mensuales de cocodrilianos en la Reserva de la Biosfera La Encrucijada en 2011.
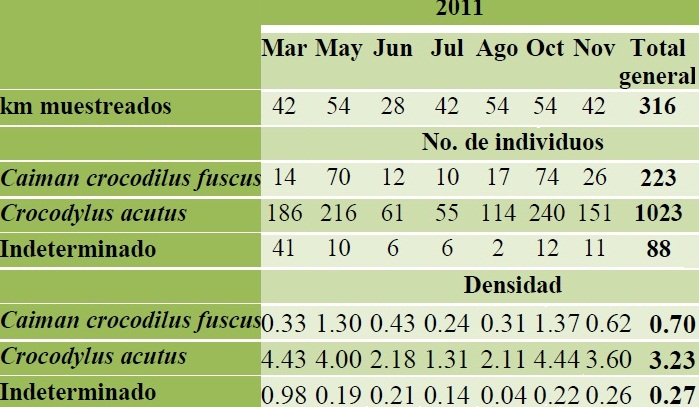
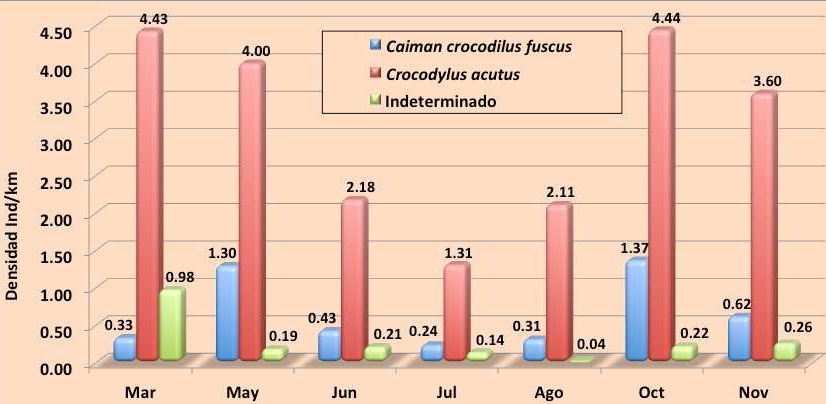 Figura 13.
Figura 13. Tendencias mensuales de las densidades de cocodrilianos en la REBIEN durante 2011.
Frecuencia y estructura de edad. La estructura de edad fue analizada con base en las longitudes del cuerpo. Bajo esta categorización, C. c. fuscus tuvo una mayor frecuencia de subadultos (clase III), ya que en esta categoría se registraron 60 individuos que corresponden al 26.9 % del total de los registros, registrándose pocos adultos, crías y juveniles. Para C. acutus se encontró una estructura de edad normal de acuerdo a una pirámide de población estable, ya que predominaron las primeras fases de desarrollo (neonatos, crías y juveniles) que sumadas corresponden al 62.8 % de los registros, también se registró un buen porcentaje de subadultos (clase III) con 23.3 % y adultos (clase >IV) con 12 %, aunque se registraron pocos adultos reproductivos; 13 individuos (Figura 14).
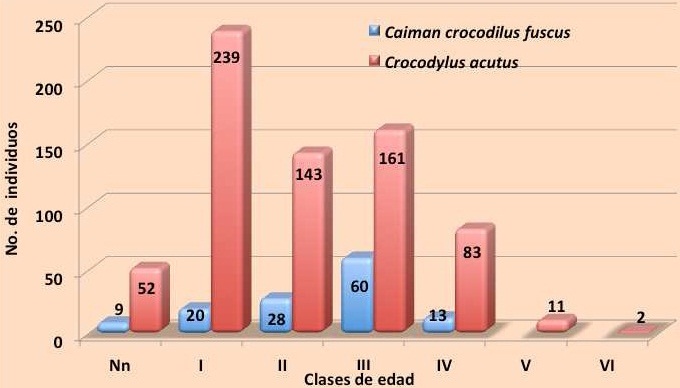 Figura 14. Frecuencia de registros de los distintos estadios de edad de ambas especies de cocodrilianos durante 2011.
Figura 14. Frecuencia de registros de los distintos estadios de edad de ambas especies de cocodrilianos durante 2011.
Frecuencia y proporción de sexos. En cuanto a la proporción de sexos, esta fue totalmente diferente para ambas especies. Mientras que en la población de C. c. fuscus existe una predominancia de machos, con una proporción de 1 hembra por 2.3 machos (1:2.3), en la población de C. acutus son abundantes las hembras, ya que por 10 hembras existen 2.4 machos (10:2.4) (Figura 15).
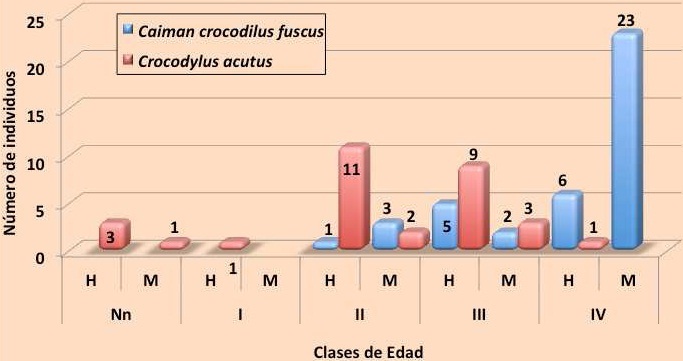 Figura 15. Proporción sexual y clases de edad de individuos de ambas especies capturados en 2011.
Figura 15. Proporción sexual y clases de edad de individuos de ambas especies capturados en 2011.
Tamaño de Población. La aplicación de las metodologías para conocer la fracción visible de la población y el tamaño de la población (N) para cada uno de los transectos, dio como resultado un mayor tamaño poblacional de C. c. fuscus (N=68.7 individuos) en el transecto T6 (Castaño-Catrín), mientras que el tamaño poblacional más pequeño (N=7.8 individuos) fue estimado en el transecto T5 (Teculapa-Panzacola). En este último transecto se estimó la mayor población (N=147.5 individuos) de C. acutus (Cuadro 6).
Cuadro 6. Tamaño poblacional estimado por transecto para ambas especies de cocodrilianos durante 2011.
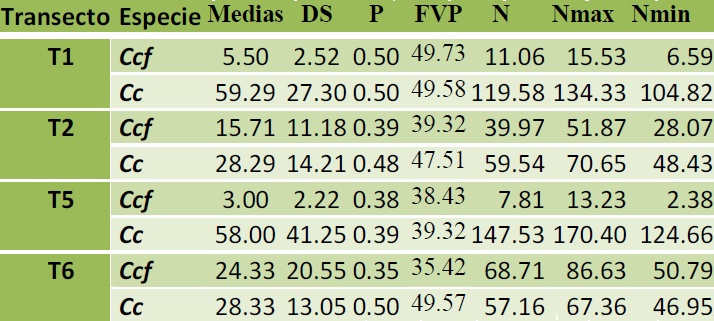
Ccc= Caiman crocodilus fuscus. Cc. Crocodylus acutus. DS, desviación estándar. FVP=fracción visible de la población. N=Número de individuos estimados. Nmax=N máxima. Nmin=N mínima.
Tendencia en la abundancia y estructura de las poblaciones de cocodrilianos de 2009 a 2011. El análisis sobre las proporciones de registros indica que a lo largo de los tres últimos años, la especie más abundante ha sido C. acutus. En términos generales la abundancia de esta especie ha sido 400 % mayor que la de C. c. fuscus. Sin embargo, se observa una ligera tendencia a la baja en la población del cocodrilo de río (de 84 % a 77 %), mientras que en la población de C. c. fuscus el patrón es inverso, elevándose el porcentaje de abundancia en un 7 % desde 2009 (Figura 16). Es importante mencionar que en 2009 el muestreo abarco cinco meses, en 2010 abarcó los 12 meses y en 2011 ocho meses, por lo que es necesario obtener más datos para validar estas tendencias.
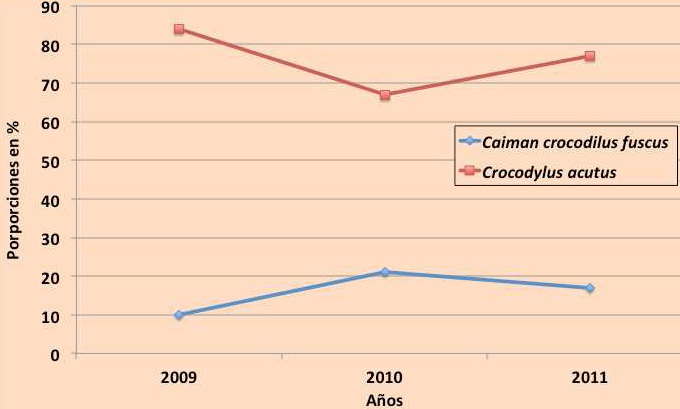 Figura 16. Proporciones de frecuencia de registros de ambas especies de cocodrilianos en el periodo 2009-2011.
Figura 16. Proporciones de frecuencia de registros de ambas especies de cocodrilianos en el periodo 2009-2011.
Un análisis de las frecuencias de registros en los últimos tres años en los transectos con mayor cantidad de datos (T1, T2 y T5), mostró que C. c. fuscus en el transecto T2 tuvo la mayor cantidad de avistamientos. En el caso de C. acutus, aunque presenta frecuencias altas en todos los transectos, destaca el transecto T1, donde la frecuencia de registros fue la más alta (Cuadro 7). Estos datos evidencian que los sitios que abarca el transecto T2 son de suma importancia para las poblaciones de caimán. En cambio, en el transecto T1 que se localiza cerca de la boca del estero o canal, se ha registrado la mayor abundancia de cocodrilos de río (Figura 16). Su distribución en esta zona tal vez se ve favorecida por la presencia de salinidad en los cuerpos de agua, lo que se refleja en su abundancia dentro del T1.
Cuadro 7. Número de individuos registrados en los transectos de muestreo de 2009 a 2011 en la reserva.
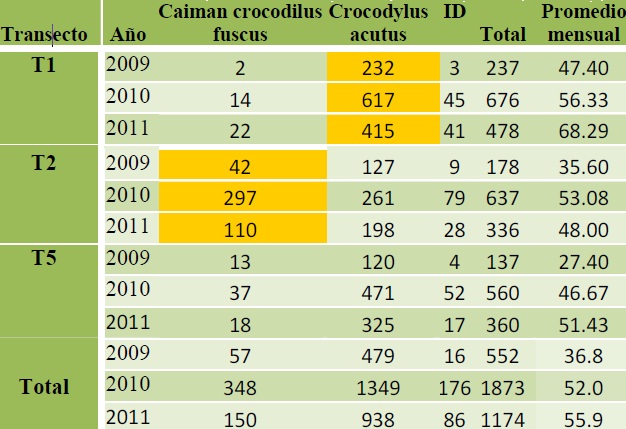
ID= Indeterminados. En amarillo, los valores más elevados de cada especie.
 Figura 17. Parte del transecto 1 (Coquitos-Concepción) donde se ubica la bocabarra San Juan que conecta con el mar y donde se han tenido gran cantidad de registros de C. acutus.
Figura 17. Parte del transecto 1 (Coquitos-Concepción) donde se ubica la bocabarra San Juan que conecta con el mar y donde se han tenido gran cantidad de registros de C. acutus.
Por otra parte, los registros promedios mensuales de ambas especies han aumentado con los años (excepto en el transecto T2 Concepción-Encuentro), lo que podría significar que, cada vez que se ha realizado el monitoreo hay una mayor eficiencia en la aplicación de las metodologías o que el tamaño de ambas poblaciones efectivamente han aumentado en los últimos años. En 2009 se registró un promedio de 36.8 ejemplares por mes, en 2010 52 y para 2011 se registraron 56 individuos como promedio mensual. Destaca que el mes de octubre ha sido el más productivo en cuanto a registros de ambas especies de 2009 a 2011.
Para saber conocer a grandes rasgos si durante el periodo de monitoreo la estructura de edad de ambas poblaciones ha cambiado o se ha mantenido, se realizó una comparación entre los datos de 2010 y 2011 (2009 tiene pocos datos); asumiendo (con las reservas de la insuficiencia de datos) que, en términos generales la estructura de edad es estable para C. acutus, ya que en ambos años predominan los estadios de neonatos, crías y juveniles y en menor porcentaje los subadultos, adultos y adultos reproductivos. En cuanto a C. c. fuscus se observa lo contrario, ya que los registros de todas las categorías de edad en 2011 fueron menores que los de 2010. Las disminuciones fueron del 71 % en los neonatos, 65 % en las crías, 64 % en juveniles, 21 % de los subadultos y del 66 % de los adultos (Figura 18).
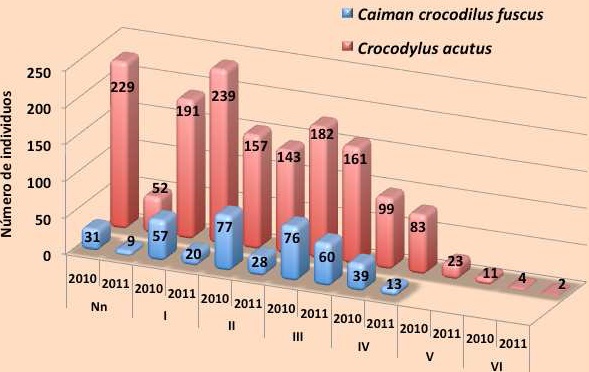 Figura 18. Frecuencias de categorías de edad de C. c. fuscus y C. acutus en 2010 y 2011 en la REBIEN.
Figura 18. Frecuencias de categorías de edad de C. c. fuscus y C. acutus en 2010 y 2011 en la REBIEN.
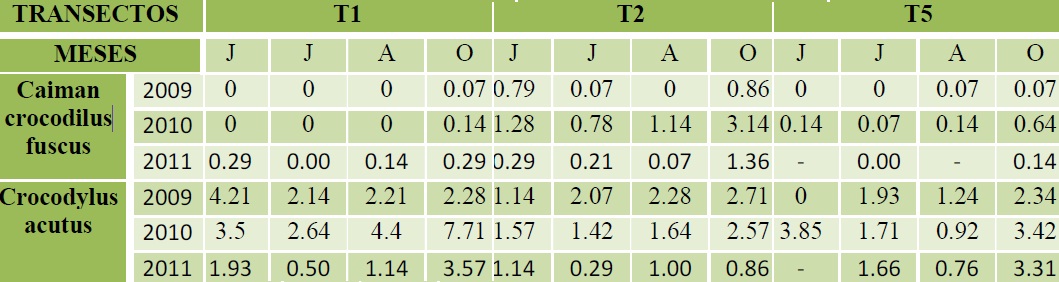
Las abundancias relativas estimadas de 2009 a 2011 muestran que C. c. fuscus se han mantenido relativamente estable, siempre por debajo de un individuo por kilómetro. En 2010 en el transecto T2, la abundancia supero el individuo por kilómetro y en octubre se registró la abundancia más alta de estos tres años, con tres individuos por kilómetro. En 2011 la abundancia más alta se presentó en octubre con más de un caimán por kilómetro (Cuadro 8). Las abundancia de C. acutus ha fluctuado a través de los años teniendo su mayor abundancia en 2010, principalmente en el T1, donde supero los siete individuos por kilómetro de recorrido; esto en octubre. En 2011 la abundancia promedio ha sido la más baja de los últimos tres años, incluso por debajo de un individuo por kilómetro en julio dentro del transecto T1 y T2 (Cuadro 8).
Cuadro 8. Abundancias de C. c. fuscus y C. acutus en tres transectos de la REBIEN de 2009 a 2011 (solo junio, julio, agosto y octubre).
Tendencias históricas en el monitoreo de cocodrilianos. Al comparar los Índices de Abundancia Relativa de los meses con más registros desde 2000 hasta 2011, se encontró que los valores han fluctuado aunque no se observa un patrón de comportamiento poblacional definido, por lo que no es posible describir con certidumbre una tendencia del comportamiento de la población de cocodrilianos (Figura 19). Cabe señalar que en cada temporada de monitoreo, el esfuerzo mínimo anual fue de cinco a seis muestreos, esfuerzo de muestreo que difiere del realizado en 2001, 2004 y 2005, en los que el número de muestreos fue más limitado, esto por factores como inundaciones, fenómenos meteorológicos extremos y falta de personal, situación que impidió un esfuerzo de muestreo sistematizado. En 2010 y 2011 pudieron realizarse 12 y ocho monitoreos por temporada respectivamente.
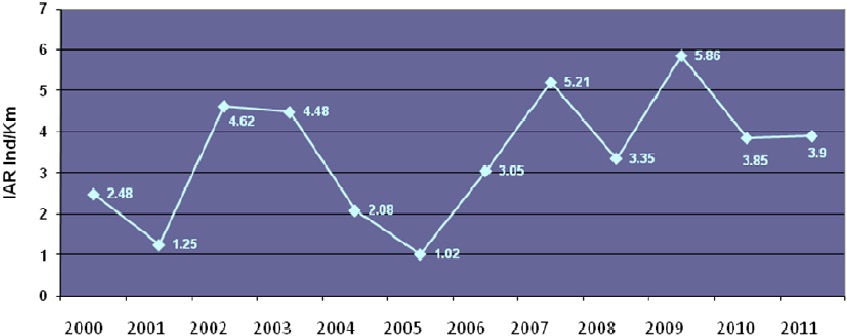 Figura 19. Promedio de registros por kilómetro de C. acutus en la REBIEN de 2000 a 2011.
Figura 19. Promedio de registros por kilómetro de C. acutus en la REBIEN de 2000 a 2011.
Discusión y conclusiones: La presencia de ambas especies, la abundancia y la representatividad de todas las clases de edad indican poblaciones viables que se han regulado en relación a las condiciones del ambiente, la disponibilidad de alimento y los factores que alteran su hábitat. Durante todos los años de monitoreo en la reserva, es evidente que la población de C. acutus es mucho mayor (cinco veces más) que la población de C. c. fuscus. Este patrón se ha conservado durante los últimos años, aunque en 2011 se registró una disminución del 7 % en las poblaciones de C. acutus con respecto al año anterior, en contraste con las poblaciones de C. c. fuscus que han aumentado en los últimos años un 7 %. En general, durante la campaña de monitoreo 2011 se registraron 1, 023 individuos de C. acutus y 223 de C. c. fuscus, con una densidad de 3.07 y 0.67 ind/km respectivamente. La densidad de cocodrilos de río es alta en comparación con otras densidades reportadas en la literatura; por ejemplo en el estero Verde, Sinaloa, se reporta una densidad de 8.4 ind/km (Navarro-Serment, et al 2002), en Perú se ha reportado una densidad de 0.18 ind/km (Escobedo y Mejía 2003), en Colombia 7.8 ind/km (Balanguera y González 2007) y en Ecuador 0.63 ind/km (Carvajal et al 2005). Por lo anterior, la REBIEN es un sitio sumamente importante para la conservación de la especie dadas sus altas densidades y abundancias. Por otro lado, las densidades de C. c. fuscus pueden considerarse bajas, ya que en el Estero Palo Blanco en el municipio de Pijijiapan, Chiapas, se ha registrado una densidad de 66 ind/km (M. Lazcano com. pers.) y dentro de la REBIEN, Martínez (1996) reportó 33.8 ind/km en el estero Las Lauras y 14.1 en la Laguna Panzacola. Considerando que en la reserva existen otros sitios donde se han reportado densidades más altas de C. c. fuscus, es recomendable incluirlos en futuros monitoreos, ya que se ampliara el grado de confiabilidad en el registro de cambios y fluctuaciones poblacionales de ambas especies.
La distribución de los cocodrilos de río y caimanes, se ve diferenciada por sus requerimientos particulares, en el caso de C. acutus en la zona de estudio se observa una presencia mayor a lo largo del año en la porción del estuario y esterillos más cercanos a las bocabarras donde la salinidad es mayor. La distribución misma de playones de anidación es otro factor que influye en la distribución de esta especie, dado que la mayoría de los suelos elevados con presencia de playones con sustrato limo-arenoso se encuentran ubicados en la porción más cercana a la Bocabarra de San Juan. Las diferencias en las densidades entre transectos, especies y cantidad de registros, sugieren estrategias de conservación y manejo distintas y específicas para cada especie. Es evidente que las comunidades humanas, aunque diferencian perfectamente a las dos especies morfológicamente hablando, en cuestiones de etología y de potencial peligro son consideradas como un solo grupo y por lo mismo aplican aspectos de “manejo” y erradicación similares. Por lo tanto, es importante desarrollar estrategias de información y control específicas que sean difundidas de manera efectiva en las comunidades. Tomando en cuenta lo anterior y considerando que dentro del ANP existen zonas donde se han reportado conflictos entre cocodrilianos y humanos, es necesario desarrollar un programa de control de riesgo. Se tienen registros de ataque de cocodrilianos a pescadores de la región; principalmente por C. acutus (especie de mayor tamaño y mayor abundancia). Los ataques a humanos, son provocados en su mayoría por la invasión a zonas de anidación, debido a que las hembras protegen los nidos permanentemente y atacan a intrusos al considerar que corren peligro sus nidos. Asimismo, se han reportado algunos ataques debido a que los humanos son confundidos con presas cuando están nadando en los ríos y lagunas, sobre todo en zonas con alta densidad de cocodrilianos. Por lo tanto, para disminuir la interacción negativa cocodrilo-humano, es necesario localizar y delimitar las zonas de riesgo de conflictos, para este proceso se deben considerar los siguientes elementos:
Una zona de alto riesgo serán las áreas donde se han localizado e identificado nidos activos; estos nidos son protegidos por las hembras y debido a una intromisión deliberada o accidental en la zona de anidamiento se tendrá altas posibilidades de provocar un ataque. Se debe enfatizar que las dos especies son totalmente distintas desde el punto de vista ecológico y que las estrategias de control y translocación deben ser distintas. Otras áreas de riesgo son los sitios o comunidades donde se han registrado ataques de cocodrilianos; aunque la ubicación exacta no es tan fácil de conseguir, se pueden ubicar a través de entrevistas con las personas afectadas. Es casi seguro que los ataques históricos han generado una mayor sensibilidad (miedo y/o rechazo) de los comuneros y para evitar futuros encuentros, es muy factible que, con tal de no sufrir otros ataques, los pescadores de estas comunidades al detectar un cocodrilo intenten sacrificarlo o capturarlo, aumentando con ello las probabilidades de ataque del animal al defenderse o sentirse amenazado. En áreas identificadas como riesgosas, se recomiendan implementar programas de señalización donde se indique la presencia de estas especies, sus nidos y el potencial peligro. Los programas de señalización deben de intensificarse de marzo a mayo y de octubre a noviembre, periodos donde la densidad de cocodrilianos es mayor.
Por otro lado, es preocupante que dentro de las poblaciones de C. c. fuscus exista una mayor proporción de machos y que se concentren en el estadio adulto. Una comunidad saludable teóricamente debe tener una mayor cantidad de hembras reproductivas que de machos, ya que permite la posibilidad de un crecimiento y mantenimiento poblacional a largo plazo. Aún no se cuenta con la información suficiente para conocer las causas de esta variación (es probable que no se deba a errores de muestreo, a no ser que las hembras por etología sean más furtivas), pero durante los últimos años de monitoreo se ha observado un aumento en la actividad pesquera y un incremento en el uso de artes de pesca no permitidos que resultan en la muerte accidental de cocodrilianos. Además, se ha observado la colonización de nuevos sitios, que en muchos casos corresponden a zonas de anidación o áreas cercanas y probablemente las actividades humanas estén modificando las condiciones microambientales y con ello modificando la estructura de la población. Por ejemplo, se debe recordar que la determinación del sexo en el desarrollo de los cocodrilos y caimanes es resultado de la temperatura microambiental prevaleciente durante la fase embrionaria dentro del huevo (Carbajal et al 2005), por lo que variaciones en ella afectaría la estructura de la población.
Por último, el esfuerzo de muestreo a lo largo de los últimos tres años ha generado importantes datos para describir patrones generales de abundancia y distribución de estos reptiles. Sin embargo, es necesario continuar con el monitoreo a largo y mediano plazo para definir y avalar los patrones y fluctuaciones poblacionales y determinar con grado de confiabilidad estadística los cambios a través del tiempo. Por esta razón deben generarse información adicional sobre la selección de microhábitat, con el objetivo de asociar la densidad de cocodrilianos con otros factores fuera de los tradicionales (temperatura y salinidad), por ejemplo, cobertura vegetal, distancia con respecto a la orilla, profundidad, grado de contaminación del cuerpo del agua, salinidad, entre otros. Dados los procesos de sedimentación que están sufriendo los humedales costeros de la REBIEN y la velocidad a la que está cambiando la batimetría de las zonas de descarga, aunado a otros factores naturales y antropogénicos que coaccionan sobre la dinámica de las poblaciones de cocodrilianos, se recomienda implementar evaluaciones de hábitat y/o utilizar indicadores a corto plazo que permitan obtener información sobre el impacto y establecer medidas de mitigación y estrategias de conservación. Deben desarrollarse programas, prevenir y controlar la cacería furtiva y el comercio ilegal, así como, desarrollar programas de crianza y reproducción en cautiverio para mantener y repoblar hábitat donde actualmente están extirpadas las poblaciones de cocodrilianos. También deben considerarse estudios de genética de poblaciones y de variabilidad genética de las poblaciones de la REBIEN, con la finalidad de determinar qué tan saludables genéticamente hablando se encuentran. La experiencia generada a través de los años de monitoreo de cocodrilianos en la REBIEN es invaluable, por lo que resulta imprescindible aplicarla a través de diversos mecanismos que permitan el intercambio de experiencias y replicar la estrategia en otras ANP, además de hacer participes a entidades académicas y de investigación. Esto mejorará y fortalecerá la estrategia de monitoreo.


|

 Figura 1. Ejemplar de cocodrilo de río (Crocodylus acutus) en la Reserva de la Biosfera La Encrucijada.
Figura 1. Ejemplar de cocodrilo de río (Crocodylus acutus) en la Reserva de la Biosfera La Encrucijada. Figura 2. Ejemplar de caimán (Caiman crocodilus fuscus) asoleándose en la Reserva de la Biosfera La Encrucijada.
Figura 2. Ejemplar de caimán (Caiman crocodilus fuscus) asoleándose en la Reserva de la Biosfera La Encrucijada. Figura 3. Localización de la Reserva de la Biosfera La Encrucijada en la costa sur de Chiapas.
Figura 3. Localización de la Reserva de la Biosfera La Encrucijada en la costa sur de Chiapas. * Transectos que no fueron recorridos en 2011.
* Transectos que no fueron recorridos en 2011.  Figura 4. Transecto 1 (Coquitos-Concepción) utilizado para la búsqueda y registro de cocodrilos en la REBIEN.
Figura 4. Transecto 1 (Coquitos-Concepción) utilizado para la búsqueda y registro de cocodrilos en la REBIEN. Figura 5. Transecto 2 (Coquitos-Encuentro), otro de los tramos para el registro de cocodrilos.
Figura 5. Transecto 2 (Coquitos-Encuentro), otro de los tramos para el registro de cocodrilos.
 Figura 6. Búsqueda y detección de los ejemplares a través del reflejo de luz de sus ojos.
Figura 6. Búsqueda y detección de los ejemplares a través del reflejo de luz de sus ojos. Figura 7. Marcaje de los ejemplares con grapas metálicas de acuerdo a su talla.
Figura 7. Marcaje de los ejemplares con grapas metálicas de acuerdo a su talla.
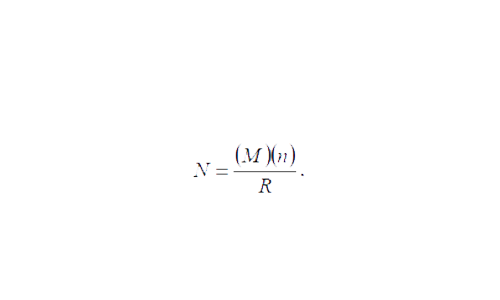
 Figura 8. Toma de medidas morfométricas (ancho interocular) de un ejemplar juvenil capturado.
Figura 8. Toma de medidas morfométricas (ancho interocular) de un ejemplar juvenil capturado.
 Figura 9. Pesaje de un ejemplar juvenil a bordo de la embarcación.
Figura 9. Pesaje de un ejemplar juvenil a bordo de la embarcación.
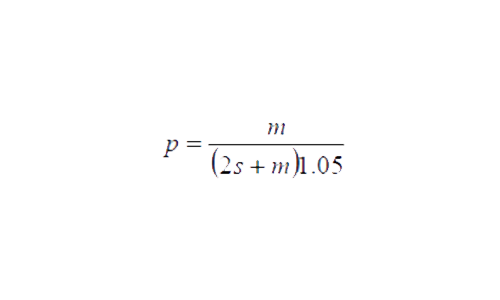
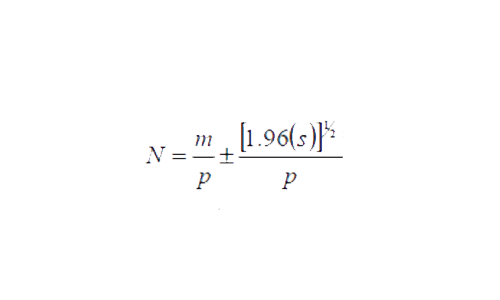
 Figura 10. Frecuencia de registro de individuos de ambas especies en la REBIEN durante 2011.
Figura 10. Frecuencia de registro de individuos de ambas especies en la REBIEN durante 2011.
 Figura 11. Individuos de cocodrilianos, de ambas especies, registrados en los transectos monitoreados durante 2011.
Figura 11. Individuos de cocodrilianos, de ambas especies, registrados en los transectos monitoreados durante 2011.
 Figura 12. Frecuencia de observación de C. c. fuscus y C. acutus en los transectos muestreados.
Figura 12. Frecuencia de observación de C. c. fuscus y C. acutus en los transectos muestreados.



 Figura 13. Tendencias mensuales de las densidades de cocodrilianos en la REBIEN durante 2011.
Figura 13. Tendencias mensuales de las densidades de cocodrilianos en la REBIEN durante 2011. Figura 14. Frecuencia de registros de los distintos estadios de edad de ambas especies de cocodrilianos durante 2011.
Figura 14. Frecuencia de registros de los distintos estadios de edad de ambas especies de cocodrilianos durante 2011. Figura 15. Proporción sexual y clases de edad de individuos de ambas especies capturados en 2011.
Figura 15. Proporción sexual y clases de edad de individuos de ambas especies capturados en 2011.
 Figura 16. Proporciones de frecuencia de registros de ambas especies de cocodrilianos en el periodo 2009-2011.
Figura 16. Proporciones de frecuencia de registros de ambas especies de cocodrilianos en el periodo 2009-2011.
 Figura 17. Parte del transecto 1 (Coquitos-Concepción) donde se ubica la bocabarra San Juan que conecta con el mar y donde se han tenido gran cantidad de registros de C. acutus.
Figura 17. Parte del transecto 1 (Coquitos-Concepción) donde se ubica la bocabarra San Juan que conecta con el mar y donde se han tenido gran cantidad de registros de C. acutus. Figura 18. Frecuencias de categorías de edad de C. c. fuscus y C. acutus en 2010 y 2011 en la REBIEN.
Figura 18. Frecuencias de categorías de edad de C. c. fuscus y C. acutus en 2010 y 2011 en la REBIEN.
 Figura 19. Promedio de registros por kilómetro de C. acutus en la REBIEN de 2000 a 2011.
Figura 19. Promedio de registros por kilómetro de C. acutus en la REBIEN de 2000 a 2011.
